기본
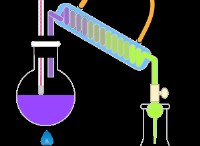
* 흡열 반응 : 이러한 반응은 주변 환경에서 에너지를 흡수합니다. 이 에너지는 종종 열 형태이지만 가볍거나 전기 또는 다른 형태 일 수도 있습니다.
* 발열 반응 : 이러한 반응은 * 에너지를 주변 환경으로, 종종 열처럼 방출합니다.
왜 그것이 사실 인 이유
* 에너지 입력 필요 : 흡열 반응은 진행하기 위해 에너지 원이 필요합니다. 그 에너지 입력이 없으면 자발적으로 일어나지 않을 것입니다. 바위를 오르막길을 밀는 것처럼 생각하십시오 - 당신은 그것을 올라가기 위해 힘 (에너지)을 적용해야합니다.
뉘앙스
* 활성화 에너지 : 발열 반응 (전반적으로 에너지를 방출하는)조차도 시작하려면 소량의 에너지 입력이 필요합니다. 이것을 활성화 에너지 라고합니다 . 경기는 경기를 조명하는 것과 같습니다. 경기는 연소 반응을 시작하기위한 초기 에너지를 제공하여 열과 빛과 같이 훨씬 더 많은 에너지를 방출합니다.
* 평형 : 일부 반응은 평형 의 점에 도달 할 수 있습니다 , 전방 (흡열) 및 역 (발열) 반응이 동일한 속도로 발생합니다. 이 경우 반응은 완전히 "정지"되지는 않지만 정지 상태에있는 것으로 보입니다.
요약
흡열 반응이 에너지 원이 필요하다는 것은 일반적으로 사실이지만, 발열 반응조차도 활성화 에너지 장벽을 가지고 있음을 기억하는 것이 중요합니다. 평형 개념은 또한 그림에 복잡성을 더합니다.