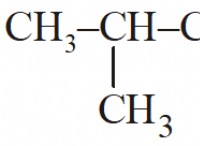* 극성 대 비극성 : NaCl은 이온 성 화합물이며, 이는 극성 용매에 용해됩니다. 헥산은 비극성 용매입니다.
* "처럼 녹는 것처럼": 화학의 일반적인 경험 법칙은 "처럼 녹는 것처럼"입니다. 이것은 극성 물질이 다른 극성 물질에 용해되는 경향이 있으며, 비극성 물질은 다른 비극성 물질에 용해됩니다.
설명 :
* naCl : 나트륨 (Na+)과 클로라이드 (Cl-) 이온 사이의 강한 이온 결합은 물과 같은 극성 용매에 의해 쉽게 파손됩니다. 물 분자는 수소 측에 부분 양전하가 있고 산소 측면에서 부분 음전하가 있습니다. 이를 통해 Na+와 클리온을 둘러싸고 효과적으로 분리하고 소금을 용해시킬 수 있습니다.
* 헥산 : 헥산은 비극성 C-H 결합을 갖는 탄화수소 (수소와 탄소로 만들어진)입니다. 물 분자와 동일한 전하 분리가 없으므로 NACL의 하전 된 이온과 효과적으로 상호 작용할 수 없습니다.
결과 : NaCl과 헥산이 혼합 될 때, 그들은 별도의 단계로 유지되며, 소금은 바닥에 침전되고 헥산은 상단에 남아 있습니다.