이유는 다음과 같습니다.
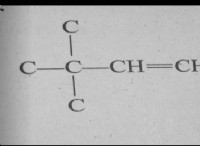
* 인 및 황 결합 : 인과 황은 다양한 화합물을 쉽게 형성하지만 가장 흔한 것은 'X'가 전한 인 황화염 (p₄sₓ)입니다. 이들 화합물은 전형적으로 백색 인 (p₄)을 황과 반응함으로써 형성된다.
* 원자가 : 인은 5 개의 원자가 전자를 가지며 황은 6이 있습니다. p₄s₅ 공식에서는 이러한 요소에 대해 전형적인 비정상적인 결합 배열이 필요합니다.
* 알려진 화합물 : 가장 흔하고 안정적인 인 황화물은 다음과 같습니다.
* p₄s> : Terraphosphorus trisulfide
* p₄s> : 헵타 설파이드 테트라 포스 포스
* p₄s> : 테트라 파스포 루스 디사 설파이드
요약 : p thes be는 이론적으로 가능할 수 있지만, 알려진 또는 일반적으로 관찰 된 화합물은 아닙니다.