1. 극성과 이온화 :
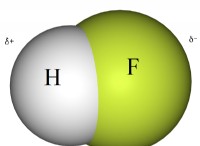
* 물은 극성 분자입니다 : 이것은 전자의 고르지 않은 공유로 인해 긍정적이고 부정적인 목적을 가지고 있음을 의미합니다. 이 극성은 물과 상호 작용하고 미네랄에서 하전 된 입자 (이온)를 분리 할 수있게한다.
* 광물은 종종 이온 성입니다 : 그것들은 정전기력에 의해 함께 유지 된 긍정적이고 음으로 하전 된 이온으로 구성됩니다.
2. 용해 과정 :
* 물 분자는 미네랄을 둘러싸고 있습니다 : 물 분자의 양의 끝은 미네랄의 음으로 하전 된 이온에 끌리는 반면, 물 분자의 음성 끝은 양으로 하전 된 이온에 끌린다.
* 물 분자는 이온을 차별화합니다. 물 분자와 이온 사이의 인력은 미네랄을 함께 유지하는 정전기력보다 강합니다.
* 이온은 수화됩니다 : 일단 분리되면, 이온은 물 분자로 둘러싸여 수화 쉘을 형성합니다. 이렇게하면 재조합을 방지하고 용해시킵니다.
3. 용해에 영향을 미치는 요인 :
* 미네랄 유형 : 다른 미네랄은 화학 성분 및 결정 구조에 기초하여 다양한 용해도를 가지고 있습니다. 예를 들어, Halite (NaCl)는 물에 쉽게 용해되는 반면 석영 (SIO2)은 매우 불용성입니다.
* 물 화학 : 물에 다른 용해 된 물질의 pH, 온도 및 존재는 용해 속도에 영향을 줄 수 있습니다.
* 표면적 : 미네랄의 표면적이 물에 노출 될수록 용해 속도가 빨라집니다.
* 유량 : 움직이는 물은 미네랄과 지속적으로 접촉함으로써 해산 속도를 증가시킵니다.
예 :
* 물에 용해되는 소금 : 염화나트륨 (NaCl)은 물에 쉽게 용해되어 나트륨 (Na+) 및 클로라이드 (Cl-) 이온으로 분리됩니다.
* 산성수에 용해되는 탄산 칼슘 : 석회석 (CACO3)과 같은 탄산염 광물은 수소 이온 (H+)과 탄산염 이온 (CO3^2-) 사이의 반응으로 인해 산성수에 용해됩니다.
요약하면, 미네랄 용해는 물 분자가 미네랄에서 이온과 상호 작용하여 그것들을 떼어 내고 수화 된 이온으로 용해시킬 때 발생합니다.