1. 선형 : 원자의 간단하고 직선 배열. 예 :
* 이산화탄소 (CO2) : o =C =O
2. 삼각 평면 : 3 개의 원자는 중앙 탄소 원자에 결합하여 평평한 삼각형을 형성합니다. 예 :
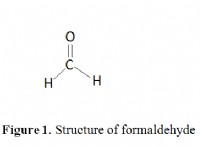
* 메탄 (CH4) : 사면체 모양이지만 하나의 수소가 다른 원자로 대체되었습니다.
* 포름 알데히드 (H2CO) : H-C (=O) -h
3. 사면체 : 4 개의 원자는 중심 탄소 원자에 결합하여 삼각형 염기를 갖는 3 차원 피라미드를 형성한다. 예 :
* 메탄 (CH4) : 이것은 가장 기본적인 모양이며, 중심에 탄소가 있고 모서리에 4 개의 수소 원자가 있습니다.
* 에탄 (C2H6) : 단일 결합으로 연결된 2 개의 사면체 탄소.
4. 구부러진 : 중앙 탄소 원자에 전자 쌍의 전자 쌍이있는 분자에서 종종 발견되는 비선형 모양. 예 :
* 물 (H2O) : 산소 원자는 2 개의 고독한 쌍을 가지므로 H-O-H 결합 각도가 180도 미만입니다.
5. 삼각 피라미드 : 사면체와 같은 삼각형베이스가 있지만 중앙 탄소 원자에 고독한 전자 쌍이있는 피라미드. 예 :
* 암모니아 (NH3) : 질소에는 고독한 쌍이있어 H-N-H 결합 각도가 109.5도 미만입니다.
6. 순환 : 탄소 원자는 닫힌 고리를 형성합니다. 예 :
* 사이클로 헥산 (C6H12) : 교대 단일 및 이중 결합이있는 6 원 링.
* 벤젠 (C6H6) : 비편성 전자가있는 6 원 링으로 방향족 특성을줍니다.
7. 복잡한 3D 구조 : 탄소는 체인, 가지 및 네트워크를 포함하여 매우 복잡한 구조를 형성 할 수 있습니다. 예 :
* 폴리머 : 폴리에틸렌과 같은 반복 탄소 단위의 긴 사슬.
* Fullerenes : Buckminsterfullerene (C60)과 같은 구형, 케이지와 같은 구조.
* 그래 핀 : 벌집 격자에 배열 된 단일 층의 탄소 원자.
탄소 분자 형태에 영향을 미치는 요인 :
* 혼성화 : 원자 궤도의 혼합은 분자의 형태에 영향을 미치는 새로운 하이브리드 화 된 궤도를 형성한다.
* 결합 각도 : 전자 쌍 사이의 반발에 의해 결정되는 결합 사이의 각도.
* 고독한 쌍 : 중앙 탄소 원자의 비 결합 전자 쌍은 모양에 영향을 줄 수 있습니다.
* 분자간 힘 : 분자들 사이의 관광 명소는 전체 모양과 구조에 영향을 줄 수 있습니다.
탄소 분자의 모양을 이해하는 것은 특성, 반응성 및 생물학적 기능을 예측하는 데 중요합니다.