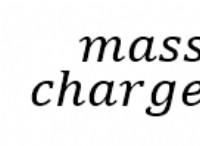개념 이해
* 두더지 : 두더지는 특정 수의 입자 (원자, 분자 등)를 나타내는 측정 단위입니다. 하나의 두더지에는 6.022 x 10^23 개의 입자 (Avogadro의 숫자)가 포함됩니다.
* 몰 질량 : 물질의 몰 질량은 그 물질의 한 몰의 질량입니다.
계산
1. 물 (H2O) :
* 물의 몰 덩어리 =18 g/mol (h x 2 + 16 g/mol의 경우 1 g/mol)
* 9g =9 g / 18 g / mol =0.5 mol의 물 몰더
* 물 9g의 분자 수 =0.5 mol x 6.022 x 10^23 분자/mol =3.011 x 10^23 분자
2. 설탕 (C12H22O11) :
* 설탕의 몰 질량 =342 g/mol (C x 12 + 1 g/mol의 경우 12 g/mol의 경우 H x 22 + 16 g/mol의 경우 O x 11)
* 9g =9 g / 342 g / mol =0.026 mol의 설탕 몰 (대략)
* 설탕 9g의 분자 수 =0.026 mol x 6.022 x 10^23 분자/mol =1.57 x 10^22 분자 (대략)
결론
9 그램의 물은 9 그램의 설탕 (1.57 x 10^22)보다 훨씬 더 많은 분자 (3.011 x 10^23)를 가지고 있습니다. 물은 설탕보다 어금니 질량이 훨씬 낮기 때문에 더 작은 물질은 더 큰 설탕과 동일한 수의 두더지 (따라서 분자)를 함유 함을 의미합니다.