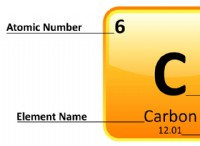
수소 (H) :
* 상태 : 실온에서 기체.
* 가연성 : 매우 가연성.
* 반응성 : 많은 요소와 쉽게 반응합니다.
* 밀도 : 매우 낮습니다.
* 끓는점 : -252.87 ° C (-423.17 ° F)
* 용융점 : -259.14 ° C (-434.45 ° F)
산소 (O) :
* 상태 : 실온에서 기체.
* 가연성 : 가연성 자체는 아니지만 연소를 지원합니다.
* 반응성 : 많은 요소, 특히 금속과 반응합니다.
* 밀도 : 공기보다 약간 밀도가 높습니다.
* 끓는점 : -183 ° C (-297.4 ° F)
* 용융점 : -218.4 ° C (-361.1 ° F)
물 (H (O) :
* 상태 : 실온에서 액체.
* 가연성 : 가연성이 아닙니다.
* 반응성 : 일부 금속 (알칼리 금속)과 반응하지만 일반적으로 반응하지 않습니다.
* 밀도 : 1 g/cm³ (4 ° C).
* 끓는점 : 100 ° C (212 ° F)
* 용융점 : 0 ° C (32 ° F)
주요 차이점 :
* 상태 : 물은 가스 인 수소 및 산소와 달리 실온에서 액체입니다. 이것은 물 분자 사이의 강한 수소 결합 때문입니다.
* 가연성 : 물은 가연성이 아니며, 수소는 가연성이 높고 산소는 연소를지지합니다.
* 반응성 : 물의 반응성은 수소 또는 산소와 유의하게 다릅니다. 수소보다 덜 반응하지만 알칼리 금속과 반응 할 수 있습니다.
* 밀도 : 물은 수소와 산소보다 밀도가 높습니다.
* 끓는 지점과 용융점 : 물은 수소 및 산소에 비해 끓는 점과 용융점이 상당히 높습니다.
이러한 차이의 이유는 새로운 화학 결합의 형성 때문입니다.
* 수소와 산소가 결합되어 물을 형성하면 공유 결합을 형성합니다. 전자가 원자 사이에 공유되는 곳.
* 전자의 공유는 개별 원자와 비교하여 완전히 다른 특성을 갖는 새로운 분자를 형성합니다.
요약 : 물의 특성은 수소와 산소 사이에서 발생하는 화학적 결합의 결과입니다. 이것은 구성 요소와 구별되는 고유 한 특성을 가진 화합물을 초래합니다.