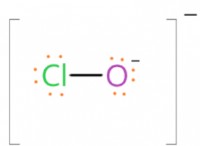산베이스 화학 소개
산과 염기는 신체의 항상성 유지, 식물 성장 유지 및 수생 생물 보존과 같은 많은 과정에 필수적입니다. 그들은 또한 집에서 발견되는 제품에도 사용됩니다. 산과 기지는 가정용 제품과 음식에 있습니다. 강한 염기 인 수산화 나트륨은 가정용 세제 및 비누에 사용됩니다. 기본 화합물 인 베이킹 소다는 구운 식품 상승에 도움이됩니다. 구연산은 레몬에게 신맛을줍니다. 식초에는 식품 청소 및 보존과 같은 많은 용도가있는 일반적인 산인 아세트산이 포함되어있어 아세트산이 포함되어 있습니다. 산성 염기 화학은 어디에나 있습니다.
산성 염기 화학은 생물의 기본 생물학적 과정을 제어합니다. 산도는 셀의 에너지 통화 인 ATP의 생산을 제어합니다. 화학 실험실은 산-염기 화학을 사용합니다. 적정은 일반적인 산-염기 반응이다. 그들은 화합물의 농도를 결정합니다.
산과 염기의 병력
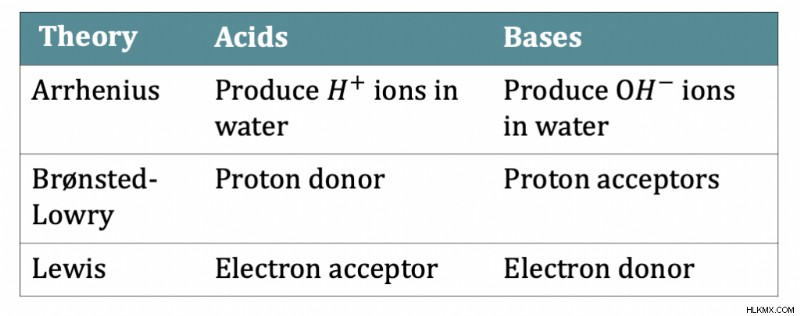
Laurent Lavoisier는 산과 염기의 첫 번째 이론을 소개했습니다. 그의 이론은 산과 염기의 탐구를 촉진했다. 산과 염기의 특성을 반영하는 첫 번째 이론은 Svante August Arrhenius였습니다. Arrhenius 정의는 산이 물에서 H+ 이온을 생성하고 기초는 물에 오리온을 생성한다고 명시합니다. 이 이론에는 몇 가지 예외가 있습니다. 예를 들어, 암모니아는 기초로 작용할 수 있지만 물에 용해 될 때 오리온을 생산하지는 않습니다.
Svante August Arrhenius와 함께 Bronsted와 Lowry는 산성이 양성자 공여자이며 염기는 양성자 수용자라는 이론을 개발했습니다. 이 이론은 물이 항상 사용되는 용매 일 필요는 없기 때문에 산 또는 염기의 정의를 확장했습니다. Gilbert N. Lewis는 산이 전자 수용체이고 염기는 전자 공여자라고 가정했다. Lewis의 이론은 전자 교환을 포함하여 산과 염기의 정의를 더욱 확대했습니다.
 산 / 염기 용액의
산 / 염기 용액의 이온
수용액은 일반적으로 물, 산, 염기 및 염의 일부 조합으로 구성됩니다. 이 화합물은 부분적으로 또는 완전히 이온화 될 수 있습니다. 즉, 화합물이 이온으로 분리됩니다.
예를 들어, 순수한 물에서, 물 분자의 작은 비율이 H 3 로 이온화됩니다. O (Hydronium 이온) 및 OH (하이드 록 사이드) 이온.
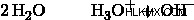
우리는 H를 H 3 의 속기로 사용합니다 기술적으로 이온이 자체적으로 존재하지 않더라도 이온.
하이드로 늄 및 수산화 이온은 수용액에서 서로 사랑하는 관계를 갖습니다. 이온이 많을수록 OH 이온이 적고 그 반대로.
pH는 무엇입니까?
pH는 산 또는 염기의 강도를 나타내는 0에서 14 사이의 숫자입니다. ph.
에 대해 자세히 알아보십시오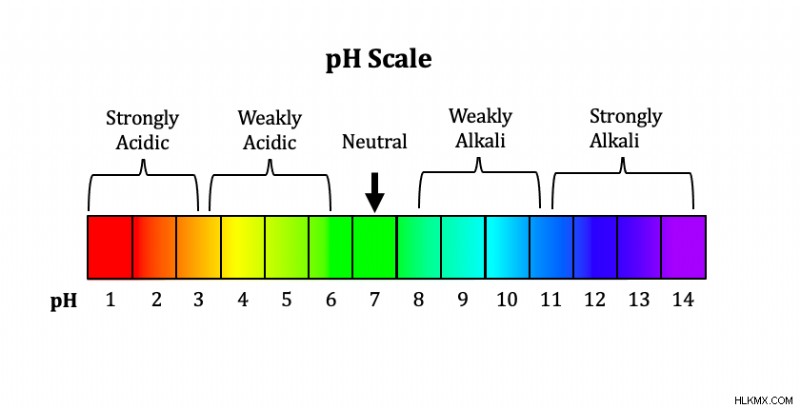
산
산 란?
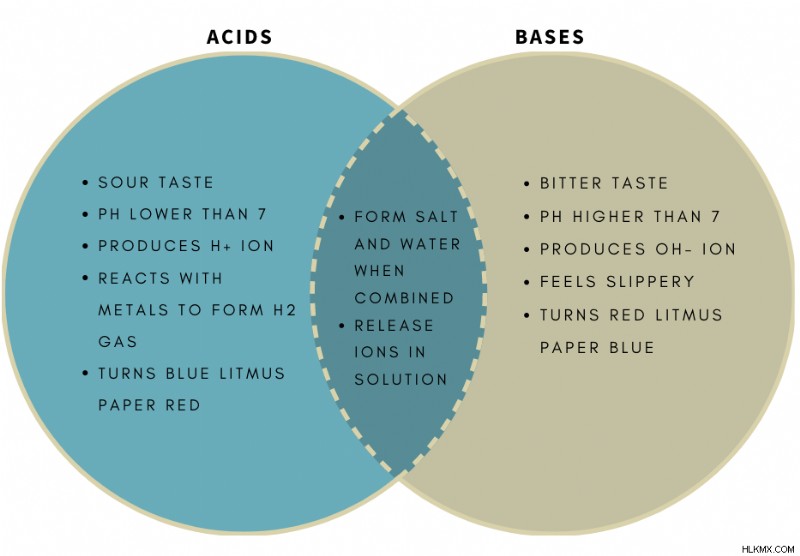
산은 양성자를 기증하거나 전자 쌍과 공유 결합을 형성 할 수있는 분자이다. 다음은 산의 더 자세한 정의입니다. 수성 형태로 산은 다음과 같은 많은 독특한 특성을 가지고 있습니다.
- 신맛
- pH 7보다 낮습니다
- 는 물에서 이온을 생산합니다
- 는 금속과 반응하여 수소 가스를 형성합니다
- 푸른 리트머스 종이를 빨간색으로 바꿉니다
산 강도
산은 강도의 수준이 다릅니다. 산 강도는 H를 염기에 기증하는 능력에 의존합니다. 강산은 물에서 완전히 이온화되어 이온이 완전히 분리되어 있습니다. 약산은 물에서만 부분적으로 분리됩니다. 강산은 피부에 접촉 할 때 매우 부식성이 있고 유해합니다. 전형적으로 강산은 pH가 0-1이고 약산은 pH가 2-6을 갖는다. 약산은 부식성이 아니며 신체와 음식에서 발견됩니다. 자세한 내용은 기사를 읽고 강산 및 기초를 읽고 PKA
산 강도에 영향을 미치는 요인은 다음과 같습니다.
- h 에 결합 된 원소의 전기 음성
- 결합 강도
요소의 전기 음성이 H에 결합 될 때, 분자의 산도가 증가한다. 더 많은 전기 음성 원자가 전자를 강하게 끌어 당기 때문에 산도는 증가합니다. 강한 전기 음성은 결합이 극성이됩니다. 결합이 극성이면, 수소는 분자로부터 분리 될 가능성이 더 높다. 결합 강도는 H에 결합 된 요소의 크기에 따라 달라집니다. 원자가 작을수록 결합 강도가 커집니다. 산에서 원자 사이의 결합 강도가 증가함에 따라 분자의 산도가 감소합니다. 예를 들어, 하이드로 플루오르 산, HF는 약산이다. F는 가장 전기 음성 원자이지만 불소가 매우 작기 때문에 HF의 결합은 강합니다. 수소와 불소 사이의 결합은 쉽게 분리되지 않습니다. 그룹 17의 히드로 할산산은 다음 순서의 강도 증가 :
hf
중요한 강하고 약산이 아래에 제시되어 있습니다. 일반적인 산에는 질산 HNO3, 황산 H 2 가 포함됩니다 그래서
염기는 양성자를 받아들이거나 공유 결합을 위해 전자 쌍을 기증하는 분자입니다. 수성 형태로, 염기는 다음과 같은 많은 독특한 특성을 가지고 있습니다.
간단히 말해서, 산은 용액에서 산소 이온을 생성하고, 염기는 수산화물 이온을 생성한다. 산 기본 이론에 대한 읽음으로써 차이점에 대해 더 깊이 얻을 수 있습니다.
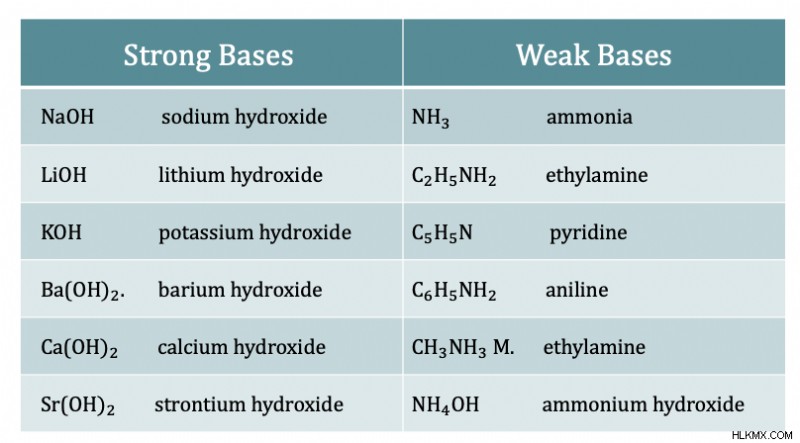
산과 마찬가지로 염기마다 강도가 다릅니다. 강하고 약한 기지가 있습니다. 기본 강도는 산으로부터 H를 수용하는 능력에 의존한다. 강산과 유사하게, 강한 염기는 물에서 완전히 이온화되어 이온이 완전히 분리되어 있음을 의미합니다. 강한 염기는 일반적으로 pH가 10-14이고 약한 염기는 pH 8-13입니다.
기본 강도에 영향을 미치는 요인은 다음과 같습니다.
동일한 행의 원자의 전기 음성 성이 주기율표에서 증가함에 따라 기본성이 감소합니다. 원자는 전자를 붙잡고 싶어하며 양성자에 기증하기를 원하지 않습니다. 원자의 원자 크기가 그룹을 낮추면 전자 밀도가 감소하여 염기성이 감소합니다. 일반적인 염기는 수산화 나트륨 NaOH, 수산화 칼륨 KOH 및 암모니아 NH 3 입니다. .
산과 염기는 서로를 중화시켜 소금과 물을 생성 할 수 있습니다. 이 산 염기 반응은 H 이온과 OH 이온의 조합으로부터 물을 생성한다. 강산과 강한 염기가 결합 될 때, pH는 정확히 7과 같다. pH는 7과 같다. 강한 염기가 약산으로 중화 될 때, pH는 7보다 크다. 반대로, 약한 염기가 강산으로 중화 될 때, pH는 7보다 작다.
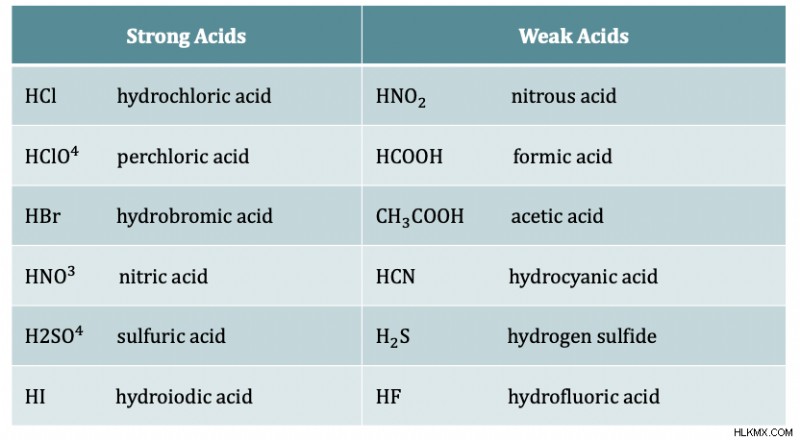
HCl은 강산 또는 약산입니까? 강한
HNO3은 강산 또는 약산입니까? 강한
아세트산은 강산 또는 약산입니까? 약한
베이스
산 vs베이스
기본 강도
산-염기 중화
다른 기사에서 다루는 주제