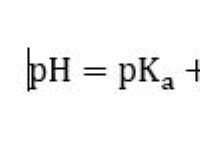* pH 스케일 : pH 스케일은 용액의 산도 또는 알칼리도를 측정하는 로그 스케일입니다. 0에서 14 사이이며 다음과 같습니다.
* 0 ~ 6.9 : 산성 용액 (높은 H+ 농도)
* 7 : 중립 용액 (동일한 H+ 및 OH- 농도)
* 7.1 ~ 14 : 알칼리성 또는 기본 용액 (하위 H+ 농도)
* 수소 이온 (H+) : 이들은 물질이 양성자 (H+)를 방출 할 때 형성되는 양으로 하전 된 이온이다. H+ 이온의 농도가 높을수록 용액이 더 산성입니다.
* 수산화 이온 (OH-) : 이들은 물에 형성되는 음으로 하전 된 이온입니다. 그것들은 H+ 이온에 반비례합니다. 더 높은 농도의 OH-는 더 낮은 농도의 H+ 및보다 알칼리성 용액을 의미한다.
pH 계산 방법 :
용액의 pH는 다음 방정식을 사용하여 계산됩니다.
pH =-log [h+]
어디:
* pH : 용액의 pH
* 로그 : Base-10 로그
* [H+] :리터당 두더지의 수소 이온의 농도 (m)
pH :에 영향을 미치는 요인
* 물질의 유형 용해 : 산은 H+ 이온을 방출하여 산도 증가 (낮은 pH). 염기는 옴을 방출하여 산도 감소 (더 높은 pH).
* 물질의 농도 : 더 높은 농도의 산 또는 염기는 더 극단적 인 pH를 초래할 것이다.
* 온도 : 온도는 물의 이온화에 영향을 미쳐 pH의 약간의 변화를 초래할 수 있습니다.
* 버퍼의 존재 : 버퍼는 H+ 이온을 흡수하거나 방출함으로써 pH의 변화에 저항하는 솔루션이다.
요약 : 용액의 pH는 용액에 존재하는 물질의 성질, 농도 및 기타 요인에 의해 영향을받는 수소 이온 (H+)의 농도에 직접적으로 의존한다.