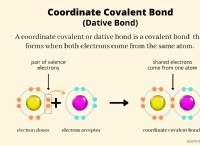
K2CRO4가 사용되는 이유 :
* 표시기 : K2CRO4는 Mohr 적정에서 지표로 작용합니다. 그의 크로메이트 이온 (CRO4^2-)은은 이온 (Ag+)과 반응하여은 크로메이트 (AG2CRO4)의 적갈색 침전물을 형성한다. 이 색상 변화는 적정의 종말점을 나타냅니다.
* 용해도 : 은 크로메이트는 적정 동안 형성된 침전물 인 염화은 (AgCl)보다 덜 가용성이다. 이것은 모든 염화물 이온이 침전 된 후 크로 메이트 이온이은 이온과 만 반응 할 수 있도록한다.
반응 :
1. 적정 : 클로라이드 이온 (Cl-)을 함유하는 용액은 질산은 (AgNO3)의 표준 용액으로 적정된다.
2. 강수 : AGNO3가 첨가 될 때, 염화 이온과 반응하여 염화은 침전물 (AGCL)을 형성한다.
3. 종말점 : 모든 염화물 이온이 반응 할 때, AgNO3의 또 다른 방울을 첨가하면 크로 메이트 이온 (K2CRO4로부터)이 과량의은 이온과 반응하여 적색 갈색은 크로메이트 침전물을 형성하게한다.
방정식 :
* 적정 : agno3 (aq) + cl- (aq) → agcl (s) + no3- (aq)
* 종말점 : 2AG + (AQ) + CRO4^2- (AQ) → AG2CRO4 (S)
요약 :
Mohr 적정은 적정의 종말점을 결정하기위한 지표로서 칼륨 크로메이트를 사용합니다. 크로 네이트 이온은 모든 클로라이드 이온이 침전 된 후에는은 이온과 반응하여 끝점을 나타내는 눈에 띄는 색 변화를 초래합니다.