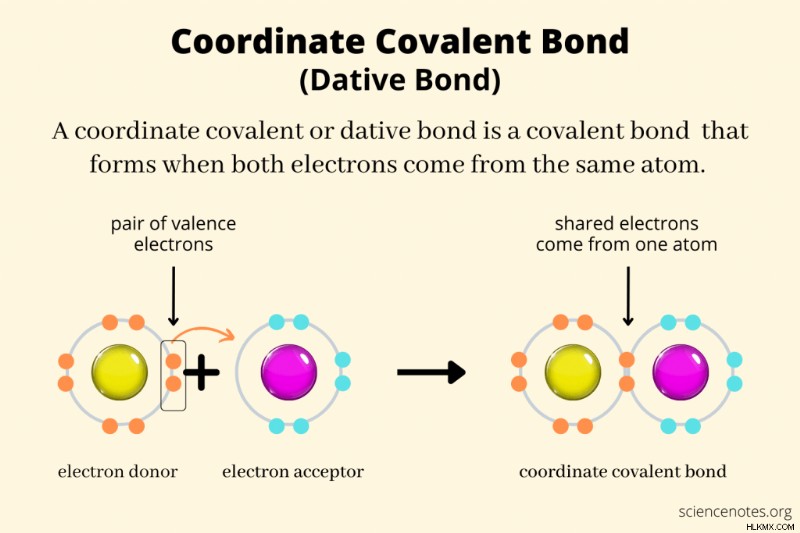
화학에서, 공유 결합 , dative bond 또는 조정 본드 공유 결합 전자가 원자 중 하나에서만 나올 때 형성되는 공유 결합의 한 유형입니다. 보다 일반적인 용어 "공유 본드"는 각 원자가 결합 전자 또는 에 기여하는 경우를 포함합니다. 하나의 원자가 두 전자를 기여할 때. 좌표 공유 결합에서, 전자 쌍에 대한 두 핵의 매력은 결합을 함께 유지한다. 루이스 산 및 염기 반응, 리간드에 결합 된 금속 이온, 때로는 비금속 사이에서 공유 결합이 형성됩니다.
.IUPAC는 "dative bond"라는 용어를 쓸모없는 것으로 간주하고 "공유 공유 채권"에 대한 "좌표 채권"을 선호합니다. 다이어그램에서는 간단한 실선 대신 화살표를 사용하여 좌표 공유 결합이 표시됩니다.
좌표 공유 결합의 예
기상 암모니아시 좌표 공유 결합 형태의 전형적인 예 (NH 3 ) 및 클로라이드 (HCL) 반응 및 암모늄 이온 (NH <서브> 4 ) 및 클로라이드 이온 및 결국 암모늄 클로라이드 (NH <서브> 4 cl). 이것은 "백인 연기"화학 데모입니다.
nh 3 (G) + HCl (G) → NH 4 cl (s)
수소 클로라이드 분자는 수소 원자 (양성자)를 암모니아 분자의 고독한 쌍으로 전달하여 암모늄 이온을 형성합니다. 암모늄 이온에서, 좌표 공유 결합은 네 번째 수소를 분자에 연결한다. 화학적 결합이 형성되면, 일반 공유 및 조정 공유 결합을 말할 방법이 없습니다. 한편, 염화 수소에서 수소가 출발하면 클로라이드 음이온이 남습니다.
암모니아와 붕소 트리 플루오 라이드 사이의 반응에서 좌표 공유 결합 형태의 또 다른 예 (bf 3 )는 암모니아 붕소 트리 플루오 라이드 (NH 3 를 형성합니다 · bf 3 ). 붕소 트리 플루오 라이드는 붕소 원자 주위에 고귀한 가스 구조를 가정하지 않기 때문에 흥미로운 화합물입니다. 붕소에는 4 쌍의 공간이 있더라도 3 쌍의 결합 전자가 있습니다. 비록 bf 3 안정적이고 전자 결핍입니다. 질소의 고독한 쌍은 베릴륨과의 결합을 형성하여 옥트 구조를 제공합니다.
다른 예로서, 일산화탄소 (CO)를 고려하십시오. 이 분자는 탄소 및 산소로부터 전자를 동일하게 공유함으로써 형성된 2 개의 공유 결합과 산소 원자에 의해 공급 된 고독한 쌍을 사용하여 하나의 좌표 결합을 함유한다.
.대조적으로, 이산화탄소 (Co 2 ) dative 유대가 있습니다. 각각의 이산화탄소 분자에는 4 개의 탄소 산소 결합이있다. 각 결합은 각 원자의 전자를 포함합니다. 결합은 공유하지만 좌표는 아닙니다.
좌표 또는 dative 결합을 함유하는 화합물의 다른 예는 다음과 같습니다.
- Hydronium 이온 (H 3 o) :산소는 전자 쌍의 공여체이고 수소는 수용체입니다.
- 클로라이드 알루미늄 (al 2 cl 6 ) :각 알루미늄 원자는 원자가 쉘을 완성하기 위해 두 개의 전자가 필요합니다. 염소 원자에는 긴 쌍이 있습니다. Al 원자는 인접한 alcl 3 에서 Cl 원자와 좌표 결합을 형성합니다. 그룹. 따라서 염화 알루미늄은 본질적으로 공유 이량 체 분자이며 이온 성 화합물이 아닙니다.
협정 결합 대 공유 결합
각 원자가 전자에 기여할 때 형성된 좌표 결합과 공유 결합 사이에는 차이가 있습니다.
- 좌표 결합은 더 극성입니다.
- 좌표 결합은 단단하고 방향성입니다.
- 좌표 결합은 일반 공유 결합보다 길다.
- 좌표 결합은 일반 공유 결합보다 약합니다.
- 조정은 반드시 두 원자 사이에 2- 전자 결합을 포함하지는 않습니다.
- 순수한 공유 결합은 동일한 요소의 두 원자 사이에서 발생할 수 있습니다 (예 :h 2 ). 좌표 결합은 항상 두 개의 다른 원자를 포함합니다.
- 좌표 화합물은 물에 드물게 용해되는 경향이 있습니다.
참조
- Iupac (1997)“Dipolar Bond”. 화학 용어의 개요 (“골드 북”) (2 판). 옥스포드 :Blackwell Scientific Publications. doi :10.1351/goldbook.d01752
- Greenwood, Norman N.; Earnshaw, Alan (1997). 요소의 화학 (2 판). Butterworth-Heinemann. ISBN :978-0-08-037941-8.
- Haaland, Arne (1989). "주요 그룹 금속에 대한 공유 대 방향 결합, 유용한 차이". Angewandte Chemie International Edition in English . 28 (8) :992–1007. doi :10.1002/anie.198909921
- Himmel, 다니엘; Krossing, Ingo; Schnepf, Andreas (2014). "주 그룹 화합물의 다이타 타입 :더 적은 화살표의 경우!". Angewandte Chemie International Edition . 53 (2) :370–374. doi :10.1002/anie.201300461
- Khare, E.; Holten-Andersen, N.; Buehler, M.J. (2021). “조정 가능한 기계적 특성을 갖는 생체 인식 거대 분자에 대한 전이 금속 좌표 결합”. nat Rev Mater . 6 :421–436. doi :10.1038/s41578-020-00270-z