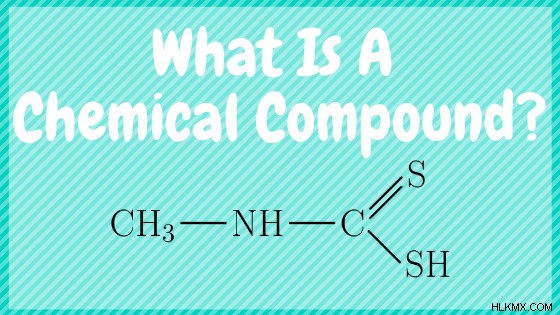
화합물 예를 들어, 2 개 이상의 상이한 화학적 요소의 결합에 의해 형성되는 화학 물질이다. 모든 화학 화합물에는 화학적 공식이 있으며, 주어진 화합물을 구성하는 요소의 상대적 비율을 설명하는 표기법입니다. 화합물은 화학 반응을 통해 상호 작용하며, 그 동안 원자 결합이 파손되어 다른 화합물로 개혁됩니다.
화합물의 결합을 유도하는 주요 메커니즘은 원자가 전자의 공유 또는 전달입니다. 화학적 화합물에는 세 가지 주요 유형의 화합물이 있으며, 각각의 원자가 함께 결합되는 방식으로 정의됩니다 :공유 화합물, 이온 성 화합물 및 금속 화합물.
화합물 대 혼합물 :화학 물질의 예
화합물은 혼합물과 다릅니다. 혼합물은 다수의 다른 원소를 포함 할 수 있지만, 혼합물에서는 어떤 요소도 서로 화학적 결합을 공유하지 않습니다. 예를 들어 강철은 혼합물입니다. 강철은 철 (Fe) 및 탄소 (C)의 양으로 구성되지만 이러한 요소는 화학적으로 결합되지 않습니다. 또한, 강철 성분의 비율은 다를 수 있습니다. 강철 샘플은 더 많은 탄소 또는 철분을 가질 수 있습니다.
반면에 화학 화합물은 화학적 결합을 공유하는 물질로 구성됩니다. 표 (NaCl)는 나트륨 원자 (NA)와 함께 결합 된 염소 원자 (CL)로 구성되기 때문에 화합물이다. 화학 화합물은 항상 동일한 비율의 구성 요소를 갖는다; 모든 소금 분자는 하나의 나트륨과 하나의 염소 원자 (NaCl)로 구성됩니다.
예를 가진 화학 화합물의 유형
3 가지 주요 종류의 화학적 화합물이 있으며, 각각 구성 원자가 함께 유지되는 방식으로 구별됩니다. 공유, 이온 성 및 금속성. 두 가지 요소가 어떤 종류의 결합에 들어가는 것은 전기성 요소에 의해 결정됩니다.
공유 화합물
공유 화합물은 원소 사이의 전자 쌍의 공유에 의해 형성되는 화학적 화합물이다. 요소는 완전한 외부 쉘과 안정적인 전자 구성을 얻기 위해 한 쌍의 전자를 공유합니다. 예를 들어, 물은 2 개의 수소 원자에 공유 결합 된 하나의 산소 원자로 구성됩니다 (H 2 영형). 산소 원자 자체는 6 개의 원자가 전자를 갖는다; 매우 불안정한 구성. 안정이되기 위해, 산소 원자는 각각 하나의 전자를 갖는 2 개의 수소 원자를 집어 들고, 따라서 산소 원자에 8 개의 전자의 전체 쉘을 제공한다.
.단지 2 개의 원자로 구성된 단순한 화합물에서 매우 복잡한 유기 거대 분자에 이르기까지 다양한 공유 결합이 있습니다. 모든 공유 결합 된 화합물은 놀이시 분자간 힘에 의해 결정되는 특정 기하학적 구조를 갖는다. 대부분의 공유 결합은 2 개의 전자의 공유로 구성되지만 일부 화합물은 1, 3, 4 또는 6 개의 전자가 공유되는 경우에 존재합니다.
전기성이 유사한 요소는 공유 결합을 만드는 경향이 있습니다. 결과적으로, 공유 결합은 다른 종류의 결합보다 상대적으로 약한 경향이 있습니다. 이산화탄소와 같은 많은 공동 공유 결합 화합물 (Co
좌표 공유 결합이라고하는 특수 유형의 공유 결합이 존재합니다. 공유 전자 쌍이 동일한 원소 또는 분자에서 기증된다는 점을 제외하고는 정상 공유 결합이 본질적으로 동일합니다.
이온 성 화합물
이온 성 화합물은 정전기력에 의해 함께 유지 된 2 개 이상의 이온으로 구성된다. 원자가 전자를 잃거나 얻을 때 이온이 형성되어 순 전하를 얻습니다. 양으로 하전 된 이온은 양이온이라고하며 음으로 하전 된 이온을 음이온이라고합니다. 반대로 하전 된 이온 사이의 매력적인 힘은 그것들을 함께 끌어 내고 단단한 화학적 결합을 형성합니다. 이온 성 화합물의 개별 이온은 연속적이고주기적인 결정 구조로 구성된 다수의 이웃 이온과 밀접하게 접촉하는 경향이있다. 예를 들어, 표는 나트륨 양이온 (NA) 및 염소 음이온 (CL)의 결합에 의해 형성되는 이온 성 화합물이다.
.이온 성 화합물은 일반적으로 전기성에서 크게 다른 원소들 사이에서 형성됩니다. 예를 들어, 주기성 테이블의 요소 군 중 하나 인 할로겐은 7 전자의 외부 전자 쉘을 갖기 때문에 매우 전기 음성입니다. 염소 (CL)와 같은 할로겐은 나트륨 (NA)과 같은 알칼리 금속과 같이 전기 음성이 아닌 원소와 쉽게 이온 결합을 형성합니다. 할로겐과 같은 극도로 전기 음성 요소는 전기 음성 요소로부터 전자를 훔쳐 양이온 및 음이온을 형성합니다. 이 양이온과 음이온은 반대 전기 전하로 인해 서로 끌어 듭니다.
이온 결합은 실온에서 고체 인 강력하고 부서지기 쉬운 화합물을 형성하는 경향이 있고, 녹는 지점이 높으며, 좋은 전기 절연체입니다. 용해되면 구성 이온이 자유롭게 움직일 수 있으므로 이온 성 화합물이 매우 전도성이됩니다.
금속 화합물
금속 화합물은 금속 양이온의 격자에 위치한 자유롭게 공유 된 전자 풀로 구성된 화합물로 설명 될 수있다. 이온 성 화합물과 마찬가지로, 금속 화합물은 순서대로 격자 구조를 갖는다. 그러나 이온 성 화합물과는 달리, 금속 화합물의 전자는 비편화되어 자유롭게 움직일 수 있습니다. 금속 화합물에서 원자가 전자의 이동성은 강도, 전도도, 연성, 광택 및 불투명도와 같은 금속의 많은 물리적 특성을 설명합니다.
많은 열린 원자가 껍질을 갖는 금속 원자 사이의 금속 결합 형태. 전자가 점유 할 수있는 가능한 많은 에너지 상태는 전자가 물질을 자유롭게 움직일 수 있음을 의미합니다. 전자는 매우 이동성이기 때문에 전기장에 의해 쉽게 영향을 받기 때문에 금속 화합물을 매우 전도성으로 만듭니다. 또한,이 자유 공유 전자 공유는 양이온 격자가 지역 본드를 쉽게 파괴하고 개혁 할 수 있음을 의미합니다. 이 속성은 금속이 가단성이 있고 연성 강도를 가진 이유입니다. 비편성 전자는 또한 금속이 특징적인 광택을 가진 이유를 설명합니다. 가벼운 파의 광자가 튀어 나와 전자에 의해 산란됩니다. 어떤면에서, 순수한 금속의 샘플을 구조에 걸쳐 전자를 자유롭게 공유하는 단일 거대한 분자를 고려할 수 있습니다.
위의 세 가지 범주는 가장 일반적인 세 가지 종류의 화학적 결합과 화합물 만 설명한다는 것을 인식하는 것이 중요합니다. 수소 결합, 반 데르 발스 힘 및 쌍극자-쌍극자 상호 작용과 같은 다른 화합물이 형성됩니다. 거대한 별들이 자기장으로 인한 특수한 유형의 화학적 결합을 만들 수 있다는 것도 이론화되어 있습니다. 가능한 화학적 결합 유형의 실제 수는 알려져 있지 않지만,이 세 가지 범주는 일상 생활에서 발생하는 대부분의 화학 결합을 포함합니다.







