산화 질소 (NO)는 단일 질소 원자와 단일 산소 원자로 구성된 기체 화합물이다. 질소 산화 질소 (질소 및 산소를 함유하는 화합물) 중 가장 간단하고 30.1 g/mol의 몰 질량을 갖는다. 산화 질소는 척추 동물 유기체에서 중요한 신호 전달 분자이며 산성 비의 주요 성분 중 하나입니다. 집중된 양으로 인간에게 독성이 있으며 심각한 의학적 문제를 일으킬 수 있습니다.
산화 질소는 자유 라디칼이다 , 짝을 이루지 않은 원자가 전자를 함유한다는 의미에서. 이 짝을 이루지 않은 원자가 전자는 산화 질소를 매우 반응성으로 만들고 화학 결합을 형성하기 쉽다. 화합물의 루이스 구조는 화합물, 결합 및 원자가 전자의 분포에서 원자의 그림 표현이다. NO에 대한 루이스 구조는 다음과 같습니다.
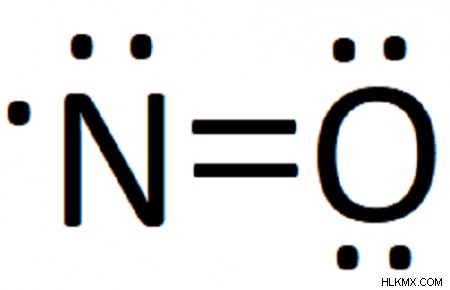
산화 질소는 질소 원자에 결합되는 단일 질소 원자로 구성됩니다. 두 화학 기호 (=) 사이의 이중 막대는 질소와 산소가 2 쌍의 전자를 공유한다는 것을 의미합니다. 마지막으로, 질소 원자에 단일 짝을 이루지 않은 전자가 있습니다. 이 자유 라디칼은 질소 산화 질소의 대부분을 설명합니다.
루이스 구조 :빠른 소개
루이스 구조 (루이스 도트 공식, 루이스 도트 구조 또는 전자 도트 구조라고도 함)는 화합물에서 원자 사이의 결합과 전자의 배치를 나타내는 그림 다이어그램입니다. 루이스 구조는 1916 년 길버트 루이스 (Gilbert Lewis)에 의해 처음 소개되었으며 그 이후로 고등학교 및 대학 화학 과정에서 표준 요금으로 채택되었습니다.
Lewis 다이어그램에는 3 개의 기본 요소가 포함되어 있습니다. 개별 원자를 나타내는 기호, 전자를 나타내는 점 및 공유 전자 쌍을 나타내는 끊임없는 라인. 루이스 구조는 전자 구성과 화합물에 공유 결합의 특성을 보여주기위한 것입니다.
각 요소는 주기율표의 화학적 기호로 표시됩니다. 전자의 구성은 화학 기호를 둘러싼 도트의 패턴으로 표시됩니다. 공유 전자 쌍의 전자 쌍은 단일 라인 ( -)으로 작성되며 공유 전자 쌍은 고독한 도트로 그려집니다. 다이어그램의 총 도트 수는 화합물에서 원자의 원자가 전자 수의 합과 같습니다. 따라서 루이스의 물 구조 (h 2 o) 2 개의 수소 원자 각각마다 1 개, 단일 산소 원자에 대해 총 8 개의 전자가 있습니다.
일반적으로, 결합을 형성 할 때, 화합물의 각 원자가 8 개의 전자로 둘러싸 일 때까지 전자가 재 배열 될 것이다. 원자가 8 개의 원자가 전자를 획득하는 경향은 옥트 규칙 로 알려져 있습니다. . 따라서, 루이스 다이어그램에 전자를 배치 할 때, 먼저 각 원자가 8 개의 전자로 둘러싸여 있도록 배열해야합니다. 옥셋 규칙에 대한 고독한 예외는 수소 (H)입니다. 수소 원자는 완전한 1s 서브 쉘에 해당하는 2 개의 원자가 전자를 가질 때까지 결합됩니다. 원자 사이에 공유되는 점 쌍은 일반적으로 본드 쌍을 나타내는 단일 끊임없는 선으로 대체됩니다.
모든 원자가 전자가 분포되고 모든 원자에 여전히 8 개의 원자가 전자가 없으면 전자는 원자 사이에 이중 및 삼중 결합을 형성하기 위해 재 배열됩니다. 전자 쌍의 배가 및 삼중화는 전자 결핍 원자가 8 개의 원자가 전자로 말단 원자를 유지하면서 더 많은 원자가 전자를 얻을 수있게합니다.
루이스 구조 구성 규칙
루이스 구조는 화합물의 전자 구성을 시각화하는 데 유용한 도구입니다. 대부분의 주요 그룹 2-7 화합물의 루이스 구조는 일련의 규칙에 따라 구성 될 수 있습니다.
1 단계. 다이어그램에서 총 원자가 전자 수를 식별
.첫 번째 단계는 다이어그램에 얼마나 많은 전자가 있어야하는지 파악하는 것입니다. 다이어그램의 총 전자 수는 개별 원자의 총 원자가 전자 수와 같아야합니다. 따라서 NO를 사용하여 우리의 예로서, NO의 루이스 구조에있는 총 전자 수는 질소 (N) 및 산소 (O)의 원자가 전자의 합과 같아야합니다. 질소에는 5 개의 원자가 전자가 있고 산소에는 6 개의 원자가 전자가 있으므로 총 다이어그램에는 6 =5 = 11 개의 전자 가 있어야합니다. .
2 단계. 원자 구조의 골격을 스케치하십시오.
이제 우리는 원자가 어떻게 배열되는지 알아 내야합니다. 화합물이 규조토 (2 개의 원자를 함유 함) 인 경우 구조는 직선 일뿐입니다. 3 개 이상의 원자를 갖는 화합물에서, 다수의 원자에 결합되는 중심 원자가있다. 일반적으로 중심 원자는 화합물의 가장 전기 음성 요소가 될 것입니다.
우리의 경우, NO는 규조토가되므로 골격 구조는 서로 옆에있는 두 가지 기호입니다.
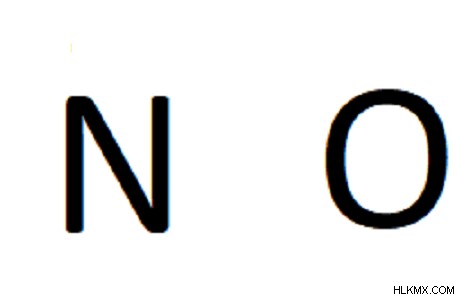
3 단계. 각 쌍 사이에 단일 결합을 배치하십시오
다음은 전자를 배치하는 것입니다. 다이어그램을 통과하고 화합물의 각 결합 원자 사이에 단일 라인을 놓습니다. 원자는 전자를 공유하여 공유 화합물을 만들므로 각 원자는 다른 원자와 하나 이상의 쌍을 공유해야합니다.
우리의 경우, 우리는 단지 n과 o :
사이에 단일 줄이 필요합니다.
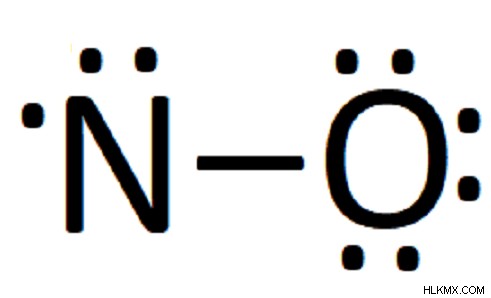
각 라인은 2 개의 전자를 나타내며, 총 라인 수를 계산하여 2를 곱하고 총 원자가 전자 수에서 빼면 나머지 전자의 수가 제공됩니다. 따라서, 우리는 11-2 = 9 전자 를 가지고 있습니다 우리의 다이어그램에 배치 할 왼쪽.
4 단계.보다 전기 음성 요소를 쳐다 보면 각 원자가 8 개의 전자로 둘러싸 일 때까지 전자를 배치합니다.
.원자는 8 개의 전자의 완전한 원자가 쉘을 가질 때까지 전자 껍질을 채우려 고합니다. 화합물에서, 전기 음성 요소가 전자에서 더 단단 해지므로 껍질이 먼저 채워지는 경향이 있습니다. 수소 (H)는 특별하며 2 개의 원자가 전자 만 얻습니다.
우리의 경우, 산소는 질소보다 전기 음성이므로 먼저 산소의 열린 슬롯을 채 웁니다. 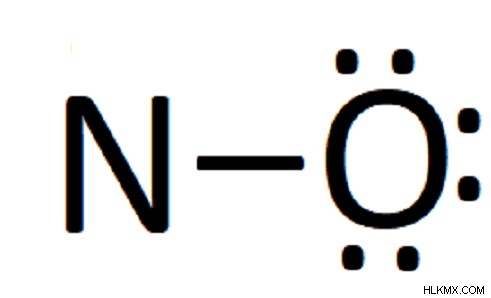
산소를 제출하는 데 6 개의 전자가 필요 했으므로 이제 3 개의 배치가 남았습니다. 나머지 전자를 배치하면
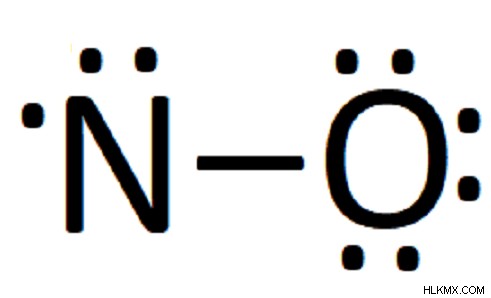
4 단계. 모든 원자가 여전히 8 개의 전자의 전체 쉘이없는 경우 전자 쌍을 이동하여 이중 및 삼중 결합을 형성합니다.
.때로는 단일 결합과 주변의 6 개의 다른 전자를 갖기에 충분한 전자가 충분하지 않습니다. 이 경우, 전자는 이중 및 삼중 결합을 형성하여 전기 음성 요소가 적은 옥트 규칙을 최대한 가깝게 만족시킬 수 있도록 이동합니다.
.우리의 경우, 모든 전자는 배치되었지만 질소에는 5 개의 전자 만 있습니다. 따라서 우리는 한 쌍의 전자를 산소에서 움직여 질소와 산소 사이의 이중 결합을 형성합니다.
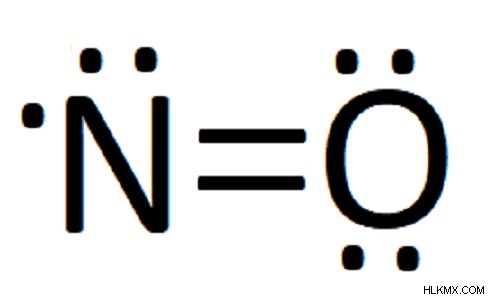 이중 선 (=)의 존재는 두 원자가 두 쌍의 전자를 공유한다는 것을 의미합니다. 이 경우, 우리는 한 쌍의 전자를 질소에 총 7 개를 줄 수 있습니다. 우리가 다른 것을 움직이려고하면 질소가 총 9 개의 원자가 전자를 가질 것이며, 이는 옥트 규칙을 위반할 것입니다. 따라서, 우리는 두 원자가 전자의 전체 덩어리를 제공하는 데 가능한 한 가깝게 얻었고, 우리의 다이어그램이 완료되었습니다.
이중 선 (=)의 존재는 두 원자가 두 쌍의 전자를 공유한다는 것을 의미합니다. 이 경우, 우리는 한 쌍의 전자를 질소에 총 7 개를 줄 수 있습니다. 우리가 다른 것을 움직이려고하면 질소가 총 9 개의 원자가 전자를 가질 것이며, 이는 옥트 규칙을 위반할 것입니다. 따라서, 우리는 두 원자가 전자의 전체 덩어리를 제공하는 데 가능한 한 가깝게 얻었고, 우리의 다이어그램이 완료되었습니다.
따라서 우리의 완성 된 루이스 구조는 다음과 같습니다.
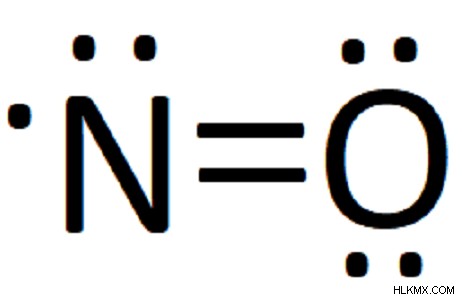
화합물로서의 산화 질소
산화 질소는 자유 라디칼 - 즉. 고독한 전자가 있습니다. 이 고독한 전자는 산화 질소를 불안정한 화학적 프로파일로 제공하고 오히려 반응성으로 만듭니다.
그것이 매우 반응성이기 때문에, 산화 질소는 다양한 조건 하에서 반응하여보다 안정적인 아산화 질소 생성물을 형성 할 것이다. 산소의 존재 하에서, NO는 다음 반응에 따라보다 안정적인 이산화 질소를 형성하기 위해 반응하지 않을 것입니다.
2no + o 2 → 아니오 2
가열되면 산화 질소는 반응에 따라 분자 산소와 질소로 분해됩니다.
2no + heat → n 2 + o 2
산화 질소는 또한 산성 비의 주요 원인 중 하나입니다. 대기 중에 방출되는 산화 질소는 수경 록시와 반응합니다 (Ho 2 ) 이산화 질소를 만들기 위해. 이산화 질소는 하이드 록실 라디칼 (OH)과 반응하여 질산을 형성 할 것이다 (HNO <서브> 3 ). 질산은 금속과 식생을 손상시킬 수있는 부식성 화합물이므로 산업과 농업의 위험이 될 수 있습니다.
루이스 구조의 한계
루이스 구조는 화합물에서 전자의 분포를 시각화하는 유용한 방법입니다. 그러나 그들은 단점이 없습니다. 구체적으로, 그룹 3-12 전이 금속으로 만들어진보다 복잡한 화합물은 종종 옥트 규칙을 따르지 않고 대신 각 원자에 12 개의 원자가 전자를 갖도록 결합됩니다. 전이 금속의 이러한 비정상적인 거동은 금속 화합물의 비편성 전자 구성 때문입니다. 마찬가지로, 때로는 단일 화합물이 하나 이상의 루이스 구조에 의해 설명 될 수있다. 이 경우, 전체 루이스 구조는 때때로 공명 구조라고하는 다른 루이스 구조의 조합으로 간주됩니다.
또한 루이스 구조는 분자의 3 차원 기하학에 대해 알려주지 않습니다. 분자의 3D 기하학은 극성 및 분자간 결합 거동과 같은 많은 물리적 및 화학적 특성을 설명합니다. VESPR 이론은 화합물의 3-D 형태와 관련된 질문과 원자의 결합 거동에 의해 이러한 형태가 어떻게 결정되는지에 대한 질문에 답하는 화학 분야입니다.
또한 루이스 구조는 how 을 설명하지 않습니다 원자는 전자를 공유합니다. 이것은 분자 궤도 이론 에 대한 질문입니다 . MO 이론은 원자 및 분자 궤도의 거동과 전자의 파도와 같은 특성으로 결합하는 방법을 설명합니다.