화학적 공식 Co
탄산염은 유연한 다 원자 이온이며 알칼리 및 알칼리 지구 금속으로 염 화합물을 형성하는 경향이 특징입니다. 탄산염 화합물은 여러 유형의 퇴적암의 주요 성분이며, 가장 잘 알려진 석회암은 주로 탄산 칼슘으로 구성됩니다 (Caco 3 ). 탄산염 화합물은 또한 연체 동물과 산호의 껍질뿐만 아니라 탄산나트륨과 같은 세척제 (NA <서브> 2 에서도 구성합니다. Co 3 ) 및 탄산 칼륨 (k <서브> 2 Co 3 ). 탄산염 화합물은 인체에서 혈액의 pH 수준을 조절하는 완충제로 사용되는 인체에서도 발견됩니다.
탄산염은 다 원자 이온이며, 2 개 이상의 원자로 만들어진 이온이라는 점에서. 먼저, 이온의 일반적인 개념을 살펴보고 다 원자 이온의 더 복잡한 아이디어를 향해 노력해 봅시다.
이온이란 무엇입니까?
간단히 말해서, 이온은 양의 양의 양성자와 전자를 갖는 원자입니다. 모든 원자는 3 가지 종류의 입자, 양성자, 중성자 및 전자로 구성됩니다. 양성자와 중성자는 원자의 핵에 묶여있는 반면 전자는 핵 주변의 궤도 껍질에 존재한다. 각 입자에는 관련된 전하가 있습니다. 양성자는 +1의 전하를 가지며 전자는 -1의 전하를 갖는다. 중성자의 중성 전하는 0입니다.
정상적인 원자에는 동일한 양의 양성자와 전자가 존재합니다. 이러한 원자에서, 양성자의 양전하와 전자의 음전 전하는 정확히 동일하고 반대이므로 전하가 상쇄되고 원자는 전반적으로 중립적이다. 그래도 항상 그런 것은 아닙니다. 원자는 전자를 얻거나 잃을 수 있으므로 전반적인 음수 또는 양전하를 취할 수 있습니다. 0이 아닌 전하를 갖는 원자를 이온 라고합니다.
두 가지 주요 이온이 있습니다. 양으로 하전 된 원자를 양이온이라고합니다 . 원자가 전자를 잃을 때 양이온이 형성됩니다. 전자보다 더 많은 양성자가 있으므로 원자는 전반적으로 양전하를 갖습니다. 음으로 하전 된 이온을 음이온이라고합니다 원자가 전자를 얻을 때 형성됩니다. 이제 양성자보다 더 많은 전자가 있으므로 원자는 전반적인 음전하를 갖습니다.
예를 들어 나트륨 (NA)을 가져 가십시오. 나트륨 원자는 11 개의 양성자와 11 개의 전자를 갖는다. 나트륨은 이온화 에너지가 비교적 낮으며, 이는 전자를 쉽게 제거 할 수 있음을 의미합니다. 따라서 나트륨은 을 잃는 경향이 있습니다 전자 및 양이온을 형성합니다. 이온의 전하는 일반적으로 화학 기호 옆의 슈퍼 스크립트 번호로 작성됩니다. 나트륨의 경우, 나트륨은 일반적으로 1 전자를 잃어 버리므로 +1의 전하가있는 이온을 형성합니다. 반면 불소 (F)는 전기성이 높고 추가 전자를 쉽게 픽업 할 수 있습니다. 불소의 원자는 외부 껍질을 채우기 위해 여분의 전자를 집어 들고 -1, f
의 전하로 이온을 만듭니다.이온은 양성과 음성 이온 사이의 강한 정전기 인력을 통해 결합을 형성합니다. 염화나트륨 (NaCl)의 경우, 나트륨 양이온은 So와 같은 염소 음이온과 결합합니다.
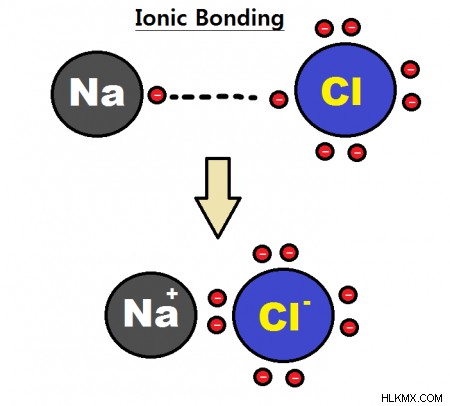
이온 결합은 이온들 사이의 더 강한 정전기 상호 작용으로 인해 공유 결합보다 강한 경향이있다. 이온 성 화합물은 일반적으로 부서지기 쉬우 며, 녹는 지점이 높고 극성 용매에 쉽게 용해됩니다.
다 원자 이온
이름에서 알 수 있듯이 다 원자 이온은 여러 원자로 만들어진 이온입니다. 다시 말해, 다 원소 이온은 단지 양성자 및 전자가 불평등 한 분자 일뿐입니다. 모나상 이온과 마찬가지로, 다 원자 이온은 전반적인 양전하 또는 음전하를 갖는다.
암모늄 (nh 4 를 가져 가십시오 ) 예를 들어. 암모늄은 단일 질소 원자와 4 개의 수소 원자로 만들어진 다 원자 이온이다. 암모늄은 총 9 개의 양성자 (질소의 경우 5 개, 각 수소의 경우 1 개) 를가하지만 8 개의 전자 만 가지고 있습니다. 따라서 암모늄의 전체 전하는 +1입니다. 암모늄은 양성자 화 (양성자 추가)에서 암모니아로 형성 될 수 있습니다 (NH 3 ). 여분의 양성자를 추가하면 전체 분자에 순 양전하가됩니다.
다 원소 이온은 산-염기 화학 반응의 맥락에서 가장 일반적으로 볼 수있다. 산성 용액은 물질로부터 수소 원자를 분리하여 형성된다. 이 과정은 자유 양성자 (H 이온) 및 상응하는 다 원소 컨쥬 게이트 염기 쌍을 초래한다. 예를 들어, 황산 (H <서브> 2 그래서
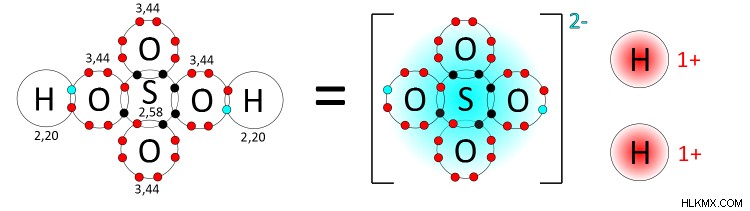
황산염 이온이 원래 수소 원자에 의해 공유 된 두 전자의 A를 유지하는 방법에 주목하십시오. 해리 된 수소 원자에서 2 개의 전자를 첨가하면 황산염 이온이 -2의 전반적인 음전하를 제공합니다.
이온 대 극성
이온과 극성 분자는 같은 것이 아닙니다. 극성 분자는 원자의 고르지 않은 공간 분포로 인해 전기 쌍극자가있는 분자입니다. 이온은 동일하지 않은 전자 및 양성자를 갖는 원자입니다. 극성 화합물은 공유 결합을 함유하고, 이온 성 화합물은 그렇지 않다. 또한, 극성 분자는 부분 전하를 가지며, 모나토미아 및 다 원자 이온은 정수 전하가 있습니다.
다 원자 이온으로서의 탄산염
탄산염은 가장 간단한 종류의 옥소 카본 이온입니다. 그것은 중심 탄소 원자에 결합 된 3 개의 산소 원자로 만들어지며 대칭 삼각 평면 형상을 갖는다. 탄산염의 몰 질량은 약 60 g/mol입니다. 그것은 탄산 산의 컨쥬 게이트 염기입니다 (h 2 Co 3 ) 그리고 용매에서 탄산 산의 해리를 통해 만들 수 있습니다.
탄산염 이온의 원자 구조는 단일 루이스 구조로 표현 될 수 없습니다. 상식은 탄산염 원자가 음성 산소에 2 개의 단일 결합을 공유하는 중심 탄소 원자와 중성 산소에 이중 결합을 공유하는 중심 탄소 원자로 구성되어 있음을 나타냅니다. 경험적 관찰은 이온이 완전히 대칭적이고 각 결합 및 산소 원자가 동일하다는 것을 나타냅니다. 따라서 탄산염은 일반적으로 공명 루이스 구조로 표현됩니다.

탄산염 이온의 실제 전자 구조는이 세 가지 별도의 수치의 평균으로 이해됩니다.
탄산염 이온은 전기적으로 음성이므로 양으로 하전 된 양이온으로 이온 결합을 형성하는 경향이 강합니다. 생성 된 물질은 일반적으로 탄산염 염이라고합니다. 일반적으로, 탄산염 이온은 그룹 1 및 2 알칼리 및 알칼리성 지구 금속을 갖는 염을 형성한다. 나트륨, 칼륨, 칼슘 및 마그네슘과 같은 알칼리 및 알칼리성 지구 금속은 양이온 양이온을 형성하여 음성 탄산염 음이온과 쉽게 결합하는 경향이 있습니다. 가장 일반적인 탄산염 염 중 하나는 탄산 칼슘입니다 (Caco
탄산염 발생
탄산 칼슘은 대부분의 종류의 퇴적암의 주요 성분입니다. 예를 들어 석회암은 주로 탄산 칼슘으로 만들어집니다. 석회암은 이온 성분으로 인해 물에 의해 용해 될 수 있습니다. 물에 석회암을 용해 시키면 칼슘 양이온과 탄산염 음이온이 제공됩니다. 미네랄 화 된 물에 의한 탄산염 염의 증착은 동굴에서 종유석과 스탈 라이트의 형성 뒤에있는 주요 메커니즘입니다.

탄산염은 또한 중요한 생물학적 물질입니다. 가장 분명히, 탄산염 화합물은 내부 pH 수준을 조절하기 위해 인체에 의해 배설됩니다. 예를 들어, 혈액 pH가 너무 낮아지면 혈액이 산성이고 수소 이온이 고농도가 있음을 의미합니다. 신체는 탄산염 이온을 생성합니다. 탄산염 이온은 혈액의 pH를 정상 수준으로 다시 높이는 과도한 양성자를 빨아들입니다. 혈액 pH가 너무 높으면 신장은 중탄산염 이온을 배설합니다 (hco 3 ), 혈액에 더 많은 수소 이온을 분리하고 생성합니다. 동일한 메커니즘이 제산제에서 탄산염 화합물의 사용 뒤에 있습니다. 탄산염 이온은 위산을 반응하고 중화시켜 산 역류 및 소화 불량의 증상을 완화시킵니다.
탄산염 화합물은 또한 대기 이산화탄소의 형성에서 중요한 부분을 차지한다. 많은 해양 유기체는 탄산염 완충 시스템을 사용하여 내부 pH 수준을 조절합니다. 그들은이 탄산염 화합물을 발산하여 차례로 이산화탄소로 전환되어 지구의 바다에서 대기로 방출됩니다. 바다의 탄산염 시스템은 대기 이산화탄소의 주요 천연 생산자 중 하나입니다. 해양 온도가 증가하면 바다에 용해 된 탄산염 화합물로부터 더 많은 이산화탄소가 형성되어 대기에서 이산화탄소의 농도가 높아질 수 있습니다.
유기 화학의 맥락에서, 단일 탄소와 3 개의 산소로 구성된 기능 그룹을 종종 탄산염이라고합니다. 기술적으로 다 원소 이온은 아니지만 탄산염 기능 그룹은 용매 특성을 포함하여 자유롭게 존재하는 이온 성 사촌의 많은 특성을 유지합니다.