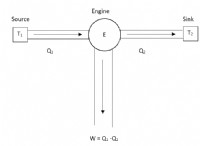
미국 과학자 Josiah Willard Gibbs는 1870 년대에 Gibbs의 자유 에너지 방정식을 발명했습니다. 그는 에너지가 시스템에서“가용 에너지”라고 말했다. 열역학 법칙과 GIBB의 자유 에너지 방정식의 이점은 실험 비용과 시간을 줄이는 것입니다.
Gibbs Free Energy는 열역학적 제 2 법칙을 기반으로하며, 이는 "추가 힘이 없으면 시스템의 고립 된 시스템 엔트로피에서 항상 증가하고 있습니다"를 의미합니다. 예를 들어, 우리가 뜨거운 금속과 차가운 금속을 함께 유지하면 열이 뜨거운 금속에서 차가운 금속으로 만 열됩니다.
깁스 자유 에너지 방정식
Gibbs Free Energy는 시스템의 엔탈피로 정의됩니다. 여기서 Gibbs 자유 에너지를위한 SI 장치는 줄라기입니다. 깁스의 자유 에너지는 화학 반응의 잠재적 추진력의 균형을 맞출 수 있습니다.
g =h-ts 여기서,
G - 깁스 자유 에너지
H - 엔탈피
T - 온도
S - 엔트로피
엔트로피 :
엔트로피는 유용한 작업을 수행하기 위해 시스템에서 사용할 수없는 단위 온도 당 열 에너지로 정의됩니다. 엔트로피의 SI 장치는 Joule / Kelvin입니다.
엔탈피 (H) :
엔탈피는 내부 에너지와 압력 시간의 합으로 정의됩니다. 엔탈피를위한 SI 장치는 joule입니다.
h =u + pv.
여기서“U”는 내부 에너지이며 내부 에너지의 SI 장치는 줄입니다.
"P"는 압력이며 압력을위한 SI 장치는 파스칼입니다. "V"는 볼륨이고 볼륨의 SI 장치는 m3
입니다.깁스 자유 에너지의 변화가 발생하면 엔탈피와 엔트로피의 변화도있을 것입니다. 따라서 우리는 다음을 표현할 수 있습니다 :Δ g =Δ h - δ (ts)
반응이 일정한 온도에서 발생한 경우 다음과 같이 방정식을 표현할 수 있습니다.
ΔG =ΔH - TΔS
Δ g =g (최종) - g (초기)
프로세스가 자발적으로 발생하면 깁스 자유 에너지의 변화는 "음성"(ΔG)
입니다.다음은 Gibb의 자유 에너지 방정식
의 몇 가지 예입니다-
자발적 과정 :
추가적인 힘없이 반응이 발생하면 자발적인 과정으로 알려져 있으며, 이는 느리거나 빠를 수 있습니다. 시스템의 자발성은 운동 또는 반응에 의존하지 않습니다.
예 :카본 다이아몬드는 흑연으로 변신합니다
-
비 픽 과정 :
추가 힘으로 반응이 발생하는 경우 자발적이지 않은 과정으로 알려져 있습니다.
예 :물에 얼음을 녹이는 것.
-
Exergonic 프로세스 :
엑서닉 반응은 에너지가 추가 힘없이 방출되는 반응으로 정의됩니다. 여기서 자유 에너지의 변화는 부정적 일 것입니다. 따라서 ΔG <0 (“G”는 음수).
-
엔도 닉 프로세스 :
엔도 닉 반응은 추가 힘으로 에너지가 방출되는 반응으로 정의됩니다. 여기서 자유 에너지의 변화는 긍정적일 것입니다. Endergonic 프로세스는 더 많은 출발 물질을 얻기 위해 반대 방향으로 작용합니다.
ΔG> 0 ( "G"는 양수)
| ΔH <0 | ΔH> 0 | |
| ΔS> 0 | ΔG <0 | TΔS는 높은 t 에서 자발적입니다 |
| ΔS <0 | TΔS는 낮은 t 에서 자발적입니다 | ΔG> 0 |