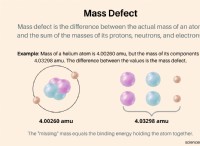
1. 액체 상태 :
* 높은 운동 에너지 : 액체의 입자는 상당한 운동 에너지를 가지고 있으며, 이는 빠르게 움직이고 진동하고 충돌합니다.
* 근접성 : 입자는 매력 (분자간 힘)에 의해 유지되며 가깝습니다.
* 유체 운동 : 입자가 움직일 수있는 자유가 있기 때문에 액체는 흐르고 용기의 모양을 취할 수 있습니다.
2. 끓는 것로 전환 :
* 에너지 입력 증가 : 액체를 가열하면 에너지를 추가합니다. 이 에너지는 입자의 운동 에너지를 증가시킵니다.
* 진동 증가 : 입자는 더 빠르고 힘으로 진동합니다.
* 채권 파괴 : 입자가 더 강하게 진동함에 따라, 그들은 그들을 붙잡고 매력적인 힘을 극복합니다.
* 기화 : 일부 입자는 액체의 표면을 피하고 기체상으로 들어갈 수있는 충분한 에너지를 얻습니다. 이것을 기화라고합니다.
3. 끓는점 :
* 임계 에너지 수준 : 끓는점은 액체의 증기압이 주변 대기압과 같은 온도입니다.
* 빠른 기화 : 끓는점에서, 충분한 입자는 액체의 표면에서 벗어날 수있는 충분한 에너지를 가지고있어 빠른 기화 (끓는).
4. 가스 상태 :
* 높은 운동 에너지 : 기체상의 입자는 액체 상보다 더 높은 동역학 에너지를 갖는다.
* 멀리 떨어져 : 입자는 멀리 떨어져 있고 그들 사이에 최소한의 매력적인 힘으로 독립적으로 움직입니다.
* 컨테이너를 채우십시오 : 가스는 그들이 차지하는 전체 컨테이너를 채우기 위해 확장됩니다.
요약 :
주요 변화는 운동 에너지의 증가입니다 입자의. 그들은 더 많은 에너지를 얻음에 따라 더 빨리 움직이고, 더 강력하게 진동하며, 결국 액체 상태에서 벗어나 가스가됩니다.