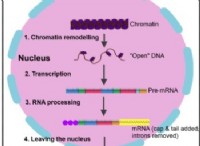
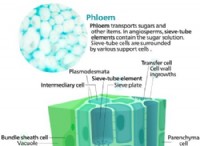
유착의 고장은 다음과 같습니다.
* 부착 다른 표면이나 분자가 서로 집착하는 경향을 말합니다. 이 힘은 반 데르 발스 힘, 수소 결합 및 정전기 상호 작용과 같은 분자간 상호 작용에서 발생합니다.
* van der waals forces 분자 내 전자 분포의 일시적 변동으로 인해 발생하는 약한 단거리 힘입니다. 그것들은 모든 분자 사이에 존재하지만 비극성 분자에 특히 중요합니다.
* 수소 결합 산소 나 질소와 같은 고도로 전기 음성 원자에 결합 된 수소를 함유하는 분자 사이에서 발생하는 더 강한 상호 작용이다. 그들은 물과 DNA와 같은 생물학적 시스템에서 중요합니다.
* 정전기 상호 작용 반대로 하전 된 분자 또는 표면 사이의 매력을 포함합니다.
접착의 예 :
* 접착제 : 접착제는 물체의 표면에 부착되어 함께 붙잡 힙니다.
* 유리에 물 : 물 분자는 수소 결합으로 인해 유리 표면에 부착됩니다.
* 벽에 페인트 : 페인트는 접착력과 응집력의 조합을 통해 벽면에 부착됩니다 (분자 사이의 인력).
접착력에 영향을 미치는 요인 :
* 표면 특성 : 관련된 표면의 특성 (예 :거칠기, 화학 성분)은 접착에 중요한 역할을합니다.
* 분자간 힘 : 두 표면의 분자 사이의 분자간 힘의 강도는 접착력의 강도를 결정합니다.
* 온도 : 접착력은 온도에 의해 영향을받을 수 있습니다. 일반적으로 더 높은 온도는 접착력을 약화시킬 수 있습니다.
응집력과 대조적으로 :
접착력은 다른 분자 사이의 매력을 다루지 만 응집력 같은 분자 사이의 매력을 나타냅니다. 예를 들어, 물 분자의 응집력은 표면 장력을 담당합니다.