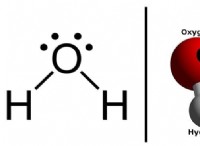
용액의 pH는 수소 이온의 농도의 척도이다. 이 용어 자체는 "수소의 힘"에 대해 느슨하게 나타나며 실제 수소 이온 농도의 부정적인 로그입니다. 이는 PH가 증가함에 따라 수소 이온 농도가 감소하고 하나의 pH 단위의 차이가 수소 이온 농도의 10 배 변화를 의미한다는 것을 의미한다. pH 값은 0에서 14 사이에 달라질 수 있습니다. 0에서 7 사이의 pH를 갖는 용액은 산성이며, 7 내지 14 사이의 pH를 갖는 용액은 기본이다. 순수한 증류수는 pH 7으로 중성이어야하지만 대기에서 이산화탄소를 흡수하기 때문에 실제로 pH 5.8의 약간 산성입니다.
.tl; dr (너무 길다; 읽지 않았다)
증류 직후 증류수의 pH는 7이지만 증류 후 몇 시간 안에 대기에서 이산화탄소를 흡수하고 pH 5.8로 산성이된다.
.산 및 염기
수도 용액에서 pH를 측정하는 것이 합리적입니다. 미네랄 오일 또는 터 펜틴과 같은 액체에는 pH가 없습니다. 산 및 염기의 청동 가운 이론에서, 산은 물에서 자유 양성자를 방출하는 화합물이며,베이스는 양성자를 받아들이는 것입니다. 양성자는 수소 원자의 핵 외에는 아무것도 아닙니다. 염산 (HCL)과 같은 강산은 용액의 pH를 극적으로 감소시키는 반면, 수산화 나트륨 (NAOH)과 같은 강한 염기는 극적으로 증가합니다. 산과 염기는 용액으로 서로를 중화시키고 결합하여 소금을 형성합니다. 예를 들어, 솔루션에서 HCL과 NaOH와 혼합되면 테이블 소금 인 NaCl을 얻습니다.
증류수는 pH 중성이어야합니다
증류 공정에는 물을 끓여서 증기가 튜브에 응축되고 용기에 응축을 수집 할 수 있습니다. 물에 용해 된 많은 물질이 많이있을 수 있으며, 일부는 물과 함께 기화 될 수 있지만 소금 및 기타 고체 용질은 뒤에 남아 있습니다. 정교한 증류 기술은 휘발성 용질조차 제거 할 수 있으며,이 중 하나를 사용하면 수집 된 응축수는 용질이 없어야하며 PH가 7이 될 것으로 예상됩니다. 증류 후 즉시 pH를 측정하면 아마도 찾을 수 있지만 곧 변경됩니다.
.순수한 물은 약간 산성입니다
순수한 물의 pH는 약 5.8로 산성입니다. 그 이유는 물이 이산화탄소를 흡수하고 대기와 평형을 이룰 때까지 계속해서 그렇게하기 때문입니다. 용액에서, 이산화탄소는 물과 반응하여 탄산을 생성하며, 이로 인해 히드로 늄 이온이 용액으로 방출되며, 이는 유리 수소 이온을 방출하는 것과 동등합니다.
.2H 2 0 + Co 2 -> h 2 o + h 2 Co 3 (탄산) -> H 3 O (Hydronium) + hco 3 (중탄산염 이온)
증류수 샘플이 대기에서 할 수있는 모든 이산화탄소를 흡수하고 최종 pH를 달성하는 데 약 2 시간이 걸립니다.