정량적 또는 실시간 PCR은 다른 실험 조건 하에서 유전자 발현의 상대적인 변화를 모니터링하기위한 일상적인 분석으로 사용됩니다. QPCR 동안의 프로브뿐만 아니라 프라이머의 설계는 분석의 품질과 성공에 영향을 미치는 가장 중요한 요소 중 하나입니다. QPCR을위한 프라이머 설계에는 여러 지침이 적용됩니다. 프라이머의 GC 함량은 35-65%여야합니다. 프라이머의 용융 온도는 60-68 ° C 이내야합니다. 또한 2 차 구조, 3 개의 염기보다 긴 GS 또는 CS의 반복 및 프라이머 다이머의 형성을 피해야합니다.
주요 영역이 적용됩니다
1. qpcr
- 정의, 프로세스, 사용
2. QPCR 용 프라이머를 디자인하는 방법
- QPCR의 프라이머 설계에 대한 지침
주요 용어 :형광 염료, GC 함량, 용융 온도, 프라이머, 정량적 PCR (QPCR)

qpcr
qpcr은 제품의 정량화를 실시간으로 정량화 할 수있는 PCR 유형입니다. 형광 염료는 각 단계에서 PCR 생성물의 정량화에 사용될 수 있습니다. 형광 표지의 두 가지 방법은 qPCR 분석에 사용될 수 있습니다. 그것들은 형광 염료와 형광-표지 프로브를 사용하는 것입니다. 형광 염료는 PCR 생성물에 결합하는 반면, 프로브는 PCR 생성물과 어닐링하여 안정적인 트리플렉스 DNA를 형성한다. QPCCR에서 널리 사용되는 형광 염료는 Sybr 녹색이고 프로브는 taqman 일 수 있습니다. QPCR 동안 PCR 생성물의 검출에 프로브를 사용하면보다 정확한 결과를 제공하고 분석의 민감도를 높입니다.
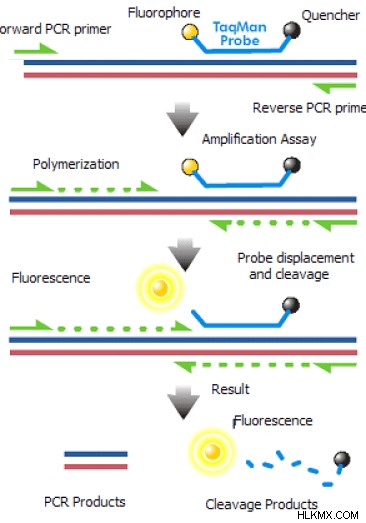
그림 1 :QPCR 메커니즘
QPCR 용 프라이머를 디자인하는 방법
QPCR을위한 프라이머 설계는 분석의 민감도를 높이는 데 중요합니다. QPCR 프라이머 설계에 대한 지침은 다음과 같습니다.
- PCR 제품/앰플 리콘 크기-PCR 제품의 크기는 크기가 50-210 기본 쌍이어야합니다.
- 프라이머 길이-프라이머의 길이는 19-23 뉴클레오티드 여야합니다.
- GC 컨텐츠-프라이머의 GC 컨텐츠는 35-65%여야합니다.
- 녹는 온도 (TM)-프라이머의 용융 온도는 60-68 ° C 여야합니다. 분석의 어닐링 온도는 프라이머의 TM보다 5 ° C가 작습니다.
- 엑손-엑손 접합-QPCR에 의해 cDNA를 증폭시킬 때 프라이머는 오염 된 DNA의 증폭을 피하기 위해 엑손-엑손 접합부에 걸쳐 있어야합니다.
- 반복 및 실행-디 뉴클레오티드 반복 (Tctctctctc) 및 반복 된 뉴클레오티드 (예 :taaaaaaaagc)를 피해야합니다. .
- 3 '상보성-프라이머-다이머의 형성을 방지하기 위해 전방 및 역방향 프라이머의 3'끝의 보완 영역을 피해야합니다.
- 3 '안정성-g 또는 c 잔류 물은 프라이머의 3'끝에 포함되어야합니다.
- GC Clamp-프라이머의 5 '끝에 1 ~ 2 개의 GC 클램프가 어닐링의 특이성을 증가시킵니다.
- 특이성-프라이머의 특이성은 Blast로 확인해야합니다
- snps-프라이머는 알려진 SNP (단일 뉴클레오티드 다형성) 변형을 포함해서는 안됩니다
Primer3, Primer-Blast, IDT Primerquest, Primer Bank 및 Oat와 같은 QPCR의 프라이머 설계에 여러 온라인 도구를 사용할 수 있습니다.
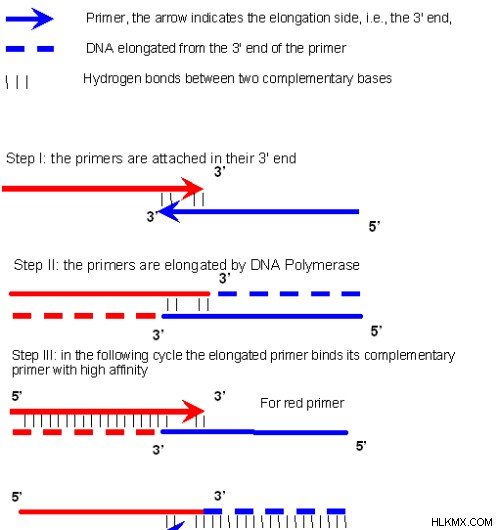
그림 2 :프라이머 다이머 형성
프라이머는 QPCR에서 프라이머 디머 형성을 피하기 위해 그러한 방식으로 설계되어야합니다. PCR 생성물의 검출을 위해 형광 염료를 사용할 때는 중요합니다.이 염료는 또한 프라이머 디머와 결합하여 잘못된 양성 결과를 제공하기 때문입니다.
.결론
qpcr은 PCR 제품의 탐지 및 정량화에 사용됩니다. 프라이머의 설계는 결과의 정확도를 높이려면 QPCR에서 중요합니다. 따라서 QPCR을위한 프라이머 설계의 지침을 신중하게 따르는 것이 중요합니다.
.참조 :
1.“QPCR 분석 설계 및 최적화.” LSR | Bio-Rad, 여기에서 사용할 수 있습니다.