주요 차이 알파와 베타 튜 불린 사이에는 알파 튜 불린이 거의 완전히 분리되어 있지만 베타 튜 불린의 ~ 10%만이 인산화된다 입니다. . 또한, 탈수 학화는 알파 튜 불린에서 발생하는 번역 후 변형의 형태를 지칭하는 반면, 베타 튜 불린의 인산화는 C- 말단 도메인에서 Ser441에서 발생한다. 또한, GTP는 항상 알파 튜 불린에 결합하는 반면 베타 튜 불린의 GTP는 미세 필라멘트와 교환하는 경향이있다.
알파와 베타 튜 불린은 미토 소매의 두 가지 주요 구성 요소이며, 이는 유사 분열, 섬유 및 깃발 수송 및 세포 형태 및 정의를 포함한 다수의 세포 과정에 관여하면서 세포 골격 구조를 만드는 데 도움이되는 이질적인 분자입니다.
주요 영역을 다루었습니다
1. 알파 튜 불린이란?
- 정의, 구조, 역할
2. 베타 튜 불린이란 무엇입니까
- 정의, 구조, 역할
3. 알파와 베타 튜 불린의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 알파와 베타 튜 불린의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어
알파 튜 불린, 베타 튜 불린, 세포 골격, GTP, Lysine, Microfilament, Microtubule, Post Translational Modifications
알파 튜 불린이란?
알파 튜 불린은 세포 골격의 형성에 중요한 역할을하는 미세 소관의 두 단백질 성분 중 하나입니다. 또한, 미세 소관은 세포 분열을 포함한 여러 세포 사건에 참여한다. 일반적으로, 미세 소관의 제 2 단백질 성분 인 알파 튜 불린 및 베타 튜 불린은 모두 3 개의 기능적 도메인을 포함하는 구형 단백질이다. 이들은 N- 말단 도메인, 중간 도메인 및 C- 말단 도메인이다. 여기서, N- 말단 도메인은 5 개의 알파 나선과 6 개의 평행 베타 가닥으로 구성되어 로스 만 접힘을 형성한다. GTP 분자는 N- 말단 도메인의 염기에 있습니다.
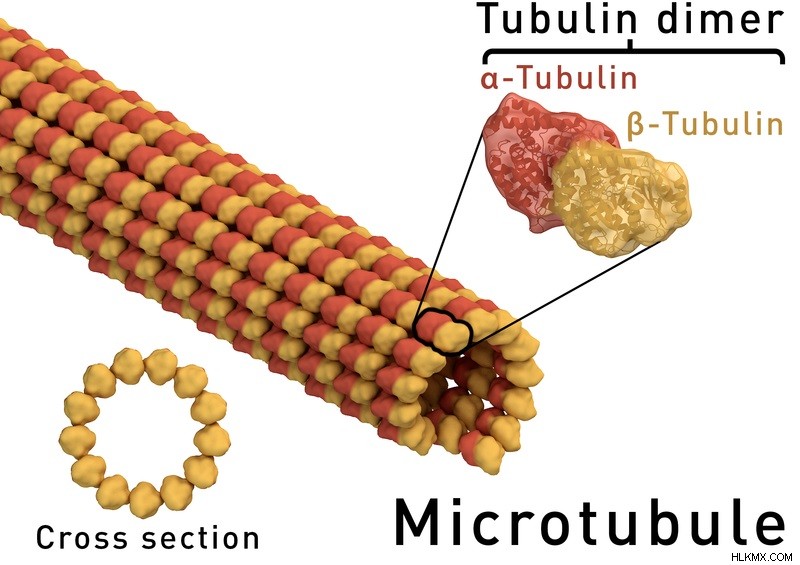
그림 1 :미세 소관 구조
반면에 중간 도메인은 3 개의 알파 나선, 베타 시트 및 2 개의 나선으로 구성됩니다. 그것은 탁솔 결합 도메인을 형성합니다. 일반적으로 Taxol은 차가운 온도 탈 중합 및 노화에 대한 시트를 안정화시키는 리간드입니다. 그러나 C- 말단은 전적으로 알파 나선으로 구성되며 다른 두 도메인과 겹치는 프로토 필라멘트 '크레스트'의 형성을 담당합니다. 그것은 다른 관련 단백질과 운동 단백질을 미세 소관에 결합 할 수 있습니다.
.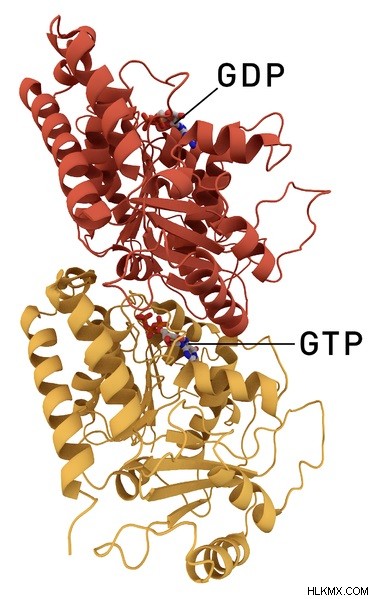
그림 2 :알파 및 베타 튜 불린 구조
또한, 미세 소관에서 알파 튜 불린의 가장 중요한 것은 그것이 GTP 분자의 결합을위한 부위를 제공한다는 것입니다. 이 GTP는 튜 불린 이량 체가 플러스 끝에 첨가되면 GDP로 가수 분해된다. 또한, GTP의 가수 분해는 알파 튜 불린의 E 부위에서 발생한다. 이 가수 분해는 254 아미노산 위치에서 발생하는 아스파 테이트 잔기에 의해 촉진됩니다.
베타 튜 불린
앞에서 언급했듯이 베타 튜 불린은 미세 소관의 두 번째 단백질 성분입니다. 254 아미노산 위치에 라이신 잔기를 함유한다. Lysine은 N- 사이트에서 GTP 포스페이트 그룹과 상호 작용함으로써 단량체-모노머 상호 작용을 강화할 책임이있다. 따라서, 베타 튜 불린은 미세 소관의 구조를 안정화시키는 데 도움이된다. 또한, N- 말단 도메인을 제외하고, GTP 분자는 튜 불린 분자의 E (교환 가능한) 부위에 결합 할 수있다. 그러나, 베타 튜 불린의 GTP는 미세 필라멘트의 중합을 위해 교환 할 수있다.
알파와 베타 튜 불린의 유사성
- 알파와 베타 튜 불린은 미세 소관의 두 가지 주요 구조 구성 요소입니다.
- 그들은 구형 단백질입니다.
- 또한, 두 분자 질량은 약 50 kDa입니다.
- 또한, 알파와 베타 튜 불린의 구조는 두 분자 모두 40% 서열 상 동성을 갖는 것과 유사하다.
- 그 외에도 그들의 구조에는 알파 나선, 베타 시트 및 임의 코일이 포함되어 있습니다.
- 그들의 단량체 구조는 α 나선으로 둘러싸인 2 개의 상호 작용 β 시트에 의해 형성됩니다.
- 추가로, 그들은 주로 진핵 생물에서 발생하는 반면 원핵 생물은 튜 불린과 관련된 단백질을 가지고 있습니다.
- 또한, 두 가지 유형의 단백질은 번역 후 변형을 겪습니다.
- 및 GTP는 튜 불린의 중합에 필요한 에너지를 미세 소관을 형성합니다.
알파와 베타 튜 불린의 차이
정의
알파 튜 불린은 GTP에 부착 된 미세 소관의 두 단백질 성분 중 하나를 말하면서 베타 튜 불린은 미세 소관의 두 번째 단백질 성분입니다. 따라서 이것은 알파와 베타 튜 불린의 근본적인 차이입니다.
구조
알파 튜 불린은 13% 알파 나선, 39% 베타 시트 및 48% 랜덤 코일로 구성되어 있고 베타 튜 불린은 13% 알파 나 나선, 42% 베타 시트 및 45% 랜덤 코일로 구성됩니다. 따라서 구조는 알파와 베타 튜 불린의 중요한 차이입니다.
254 아미노산
또한 알파와 베타 튜 불린의 또 다른 차이점은 알파 튜 불린이 254 아미노산으로 아스파 테이트를 함유하고 베타 튜 불린은 254 아미노산으로 라이신을 함유한다는 것입니다.
.254 아미노산의 기능
또한 254 번째 아미노산의 기능은 알파와 베타 튜 불린의 차이를 만듭니다. 알파 튜 불린의 254 아미노산은 E- 사이트에서 뉴클레오티드의 가수 분해를위한 이상적인 잔류 물로 작용하는 반면, 베타 튜 불린의 254 아미노산은 N- 사이트에서 GTP 포스페이트 그룹과 상호 작용함으로써 단량체-모노머 상호 작용을 강화시킨다.
.GTP 결합
GTP는 항상 알파 서브 유닛에 부착되어 있고 β 서브 유닛에서, GTP는 미세 필라멘트가 중합 될 수 있도록 교환 할 수있다. 따라서 이것은 알파와 베타 튜 불린의 또 다른 차이점입니다.
번역 수정 후
무엇보다도 알파와 베타 튜 불린의 주요 차이점은 알파 튜 불린이 거의 완전히 무 디라 화되고 베타 튜 불린의 ~ 10%가 인산화된다는 것입니다.
.번역 후 변형의 특성
위의 차이에서 비롯된 DeTyrrosination은 C- 말단 티로신의 제거를 담당합니다. Beta Tubulin의 인산화는 C- 말단 도메인에서 Ser441에서 발생합니다. 따라서 이것은 또한 알파와 베타 튜 불린의 차이입니다.
결론
알파 튜 불린은 미세 소관의 두 단백질 성분 중 하나입니다. 그것은 번역 후 변형으로서 거의 완전히 디티 로스화 된 구형 단백질이다. 또한, 알파 튜 불린에 결합 된 GTP는 튜 불린의 중합을위한 에너지를 제공한다. 한편, 베타 튜 불린은 미세 소관의 두 번째 단백질 성분이다. 또한, 그것은 구형 단백질이 때때로 인산화를 겪는다. 베타 튜 불린의 주요 기능은 단량체-모노머 상호 작용을 강화하는 것입니다. 따라서 알파와 베타 튜 불린의 주요 차이점은 구조와 기능입니다.