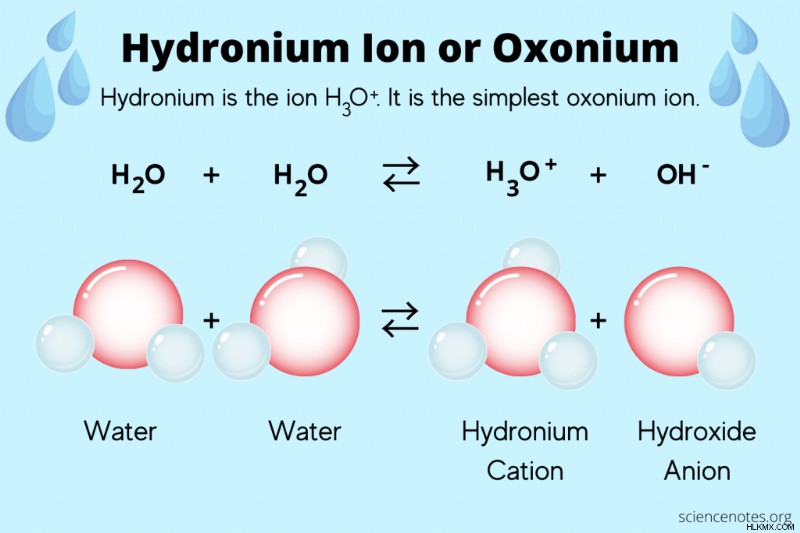
화학에서 히드로늄 또는 Hydronium 이온 화학 종 H 3 를 나타냅니다 O. Hydronium은 가장 간단한 옥소 늄 이온 입니다 , 여기서 옥소 늄 이온은 3 개의 화학 결합을 갖는 산소 양이온이다. 국제 순수 및 응용 화학 (IUPAC)은“옥소 늄”또는“하이드 록 소니 늄”이라는 용어가“히드로 늄”이라는 단어 대신 사용될 것을 권장합니다. 그러나 히드로늄은 이온의 공통 이름으로 남아 있습니다.
물에서 유리 수소가 없음
수소 이온 (H)은 수용액 및 pH 계산의 화학적 방정식으로 나타나지 만 자유 수소 이온은 실제로 물에 떠 다니지 않습니다. 대신, 양성자 (수소 이온)의 엄청나게 높은 양전하 밀도는 하나 이상의 물 분자와 즉시 연관되어 하이드로 늄을 형성합니다.
따라서 물의 자동 용해에 대한 한 가지 방정식은 다음과 같습니다.
H 2 O → H (aq) + Oh (aq)
그러나보다 정확한 화학 방정식은 Hydronium :
를 보여줍니다2 h 2 O ( l ) H 3 o ( aq ) + OH ( aq )
히드로늄 구조
이 방정식조차도 과도한 단순화입니다. 물이 자동으로 소포 될 때, 수소 이온이 항상 단일 물 분자와 관련되어 있고, 수소 늄을 형성하는 것은 아닙니다. 종종, 양성자는 여러 분자와 연관되어 서로 연관되어 서로 연관되어 있습니다. 유사하게, 수산화물 이온은 다수의 물 분자와 상호 작용한다.
냉수에서, 히드로 늄 이온은 평균 6 개의 물 분자와 상호 작용한다. 그러나 다른 구조가 발생합니다. 예를 들어, h 3 o (h 2 o)
히드로 늄 이온 자체는 피라미드의 정점에 산소가있는 삼각 피라미드의 형태를 취합니다. 이온의 질량 중심은 산소 이온에 가깝습니다. 결합 각 H-O-H는 약 113 °입니다.
히드로 늄의 중요성
히드로 늄 이온의 개념은 pH 계산, 산-염기 화학 및 성간 화학에서 중요하다.
따라서 pH 공식은 두 가지 형태를 취합니다 :
pH =-log [h]
pH =-log [h 3 o]
수소 이온 또는 히드로 늄 이온은 Arrhenius 산 정의의 기초를 형성합니다. 따라서 염산의 해리는 다음과 같습니다.
HCL (aq) + H 2 o → h 3 o (aq) + cl (aq)
대부분의 계산의 경우 H를 사용하든 h 3 상관 없습니다. O, 그러나 흥미로운 화학은 화합물에서 양이온 역할을하는 수평물과 관련된 일부 흥미로운 화학을 알고 가치가 있습니다. 예를 들어, 일부 강산은 하이드로 늄 염의 결정을 형성합니다. 1 :1의 비율로 액체 무모한 과염소산 및 물을 혼합하여 고체 히드로 늄 과염소산염 (H 3 를 형성합니다. o · clo 4 ).
성간 화학에서, 히드로 늄은 확산 및 조밀 한 분자 구름, 성간 매체 및 혜성 혈장 꼬리에서 발생합니다. 일반적으로 이것은 H 2 의 이온화로 시작됩니다 (분자 수소)로의 H 2 우주 방사선으로. 그러나, 물, 하이드로 늄 이온 및 수산화 이온을 형성하는 몇 가지 재조합 반응이 가능하다.
참조
- Burgot, Jean-Louis (1998). “의미와 ka의 값에 대한 새로운 관점 ○ (h 3 o, H 2 o) 및 KB ○ (H 2 O, OH) 물에 짝을 이룹니다.”. 분석가 . 123 (2) :409–410. doi :10.1039/a705491b
- Herbst, E.; Klemperer, W. (1973). “조밀 한 성간 구름에서 분자의 형성과 고갈”. 천체 물리학 저널 . 185 :505. doi :10.1086/152436
- iupac (1997). "옥소 늄 이온". 화학 용어의 개요 (“골드 북”) (2nd ed.). Blackwell Scientific Publications, 옥스포드. ISBN 0-9678550-9-8. doi :10.1351/Goldbook
- Meister, Erich; Willeke, Martin; 불안, 베르너; Togni, Antonio; Walde, Peter (2014). “화학 교과서에서 Brønsted-lowry 산-염기 평형의 정량적 설명-화학 교육자들을위한 비판적 검토 및 설명”. helv. 크림. Acta . 97 (1) :1–31. doi :10.1002/HLCA.201300321
- Olah, George A. (1998). onium 이온 . John Wiley &Sons. ISBN 9780471148777.