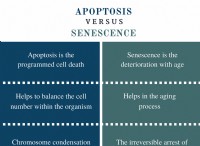
1. 염료 제외 분석 :
* Trypan Blue 배제 : 이것은 고전적인 방법입니다. 살아있는 세포는 염료가 유입되는 것을 방지하는 손상되지 않은 세포막을 가지고 있으며, 죽은 세포는 막이 손상되어 염료가 세포질 청색으로 들어가서 염색 할 수 있습니다.
* 요오드 라이드 (PI) 제외 : Trypan Blue와 유사하게, PI는 죽은 세포에 들어가지만 살아있는 세포가 아닌 형광 염료입니다.
2. 대사 활동 분석 :
* MTT 분석 : 이 비색 분석은 살아있는 세포에서 미토콘드리아 효소의 활성을 측정합니다. 살아있는 세포는 MTT (노란 테트라 졸륨 염)를 포르 마잔으로 감소시킨다.
* Resazurin 감소 분석 : 이 형광-기반 분석은 살아있는 세포에 의한 리소 루핀 (비 형광)으로의 레즈 사린 (비 형광)의 감소를 측정한다.
* ATP 분석 : 이 분석은 살아있는 세포에서 발견되는 주요 에너지 분자 인 아데노신 트리 포스페이트 (ATP)의 수준을 측정합니다.
3. DNA 염색 :
* Hoechst 33342 : 이 염료는 DNA에 결합하며 살아있는 세포와 죽은 세포를 염색하는 데 사용됩니다. 그러나, 살아있는 세포는 죽은 세포와 비교하여보다 뚜렷한 청색 형광을 나타낸다.
* dapi : Hoechst와 유사하게 Dapi는 DNA를 염색하는 형광 염료입니다. 살아있는 세포는 죽은 세포에 비해 더 밝고 더 강한 푸른 형광을 나타낸다.
4. 세포주기 분석 :
* 유세포 분석법 : 이 기술은 레이저와 형광 염료를 사용하여 세포의 DNA 함량을 분석하여 세포주기의 상이한 단계에서 세포들 사이의 구별을 허용한다. 죽은 세포는 종종 단편화 된 DNA를 나타내며 특정 염색 패턴을 통해 확인 될 수 있습니다.
5. 기타 기술 :
* Calcein AM/Ethidium homodimer-1 (Ethd-1) 분석 : 이 분석은 두 개의 형광 염료를 결합합니다. 비 형광 분자 인 Calcein AM은 살아있는 세포에서 활성 에스 테라 제에 의해 녹색 형광 염료로 전환된다. 적색 형광 염료 인 ETHD-1은 손상된 막이있는 죽은 세포에만 들어갑니다.
* 자동화 된 시스템으로 셀 계산 : 일부 자동화 된 셀 카운터는 이미징 및 분석 알고리즘을 사용하여 형태 및 내부 특징에 따라 라이브 및 죽은 셀을 구별합니다.
중요한 고려 사항 :
* 정확도 : 방법의 선택은 셀 유형, 실험 목표 및 사용 가능한 리소스에 따라 다릅니다. 특정 응용 프로그램에 정확하고 신뢰할 수있는 메소드를 선택하는 것이 중요합니다.
* 특이성 : 일부 기술은 특정 유형의 세포 사멸 (예 :아 pop 토 시스 또는 괴사)에 대해 더 구체적입니다.
적절한 정량화 기술을 사용함으로써, 연구자들은 배양에서 세포의 생존력을 정확하게 평가할 수 있으며, 이는 세포 과정, 약물 효능 및 다양한 실험 조건의 효과를 이해하는 데 필수적이다.