Gay-Lussac의 법률에 따르면,``지속적인 부피에서 가스의 압력은 켈빈의 절대 온도에 직접 비례합니다.
모든 에어로졸 캔에는‘햇빛으로부터 보호하고 50 ° C를 초과하는 온도에 노출되지 않는 경고 라벨이 있습니다. 에어로졸이 고온에 노출되면 내부 가스 압력이 증가합니다. 얼마 후, 컨테이너가 더 이상 고압 가스를 고정 할 수없고 궁극적으로 폭발 할 수있는 지점에 도달합니다.
에어로졸은 가스의 압력과 온도가 서로 밀접하게 관련되어 있기 때문에 폭발 할 수 있습니다. Gay-Lussac의 법칙은 가스의 온도와 압력 사이의 이러한 관계를 설명합니다.
Gay Lussac Law Formula
Gay-Lussac의 법률에 따르면``이상적인 가스의 압력은 부피가 일정하게 유지 될 때 절대 온도에 직접 비례합니다 ''라고 말합니다. 법은 수학적으로
로 표현됩니다p> t
p =kt
여기서 P는 가스의 압력이며 일반적으로 Hg의 ATM 또는 MM에서 측정되며, T는 켈빈의 가스의 절대 온도이며 K는 비례의 상수입니다.

캡틴 아메리카와 버키, 압력과 온도는 진정한 우정 목표입니다.
가스의 온도와 압력이 법을 철저히 이해하도록 정의되고 측정되는 방법을 살펴 보겠습니다.
가스의 동역학 이론은 온도를 가스 분자의 평균 운동 에너지로 정의합니다. 이 이론은 가스를 일정한 운동 상태에있는 미세한 입자 (모노 토미 가스 및 규조적 가스의 경우 분자의 경우 원자)의 수집으로 가정합니다. 움직임은 전적으로 무작위이며 빠른 속도로 진행됩니다. 입자는 또한 서로 지속적으로 충돌하는 것으로 가정하고 포함 된 용기의 벽.

가스의 분자는 일정한 임의의 움직임 상태에 있고 용기의 벽과 충돌하는 것으로 가정합니다. (사진 크레딧 :A. Greg/Wikimedia Commons)
단일 분자의 운동 에너지는 질량 및 속도 제곱의 생성물의 절반으로 제공됩니다 (K.E =MV2/2). 온도는 분자의 평균 번역 운동 에너지의 척도로 정의되기 때문에 가스 분자의 온도와 운동은 서로 비례합니다.
t 2 mv2/2
여기서 t는 온도이고, m은 단일 분자의 질량이고, v는 운동 속도를 나타낸다.
분자의 질량이 일정하므로, 운동 에너지는 분자의 속도가 증가하는 경우에만 증가 할 수있다. 따라서, 온도의 상승은 분자의 속도의 증가를 초래한다. 뜨거운 가스에서, 분자는 차가운 가스의 분자에 비해 더 빠른 속도로 움직입니다.
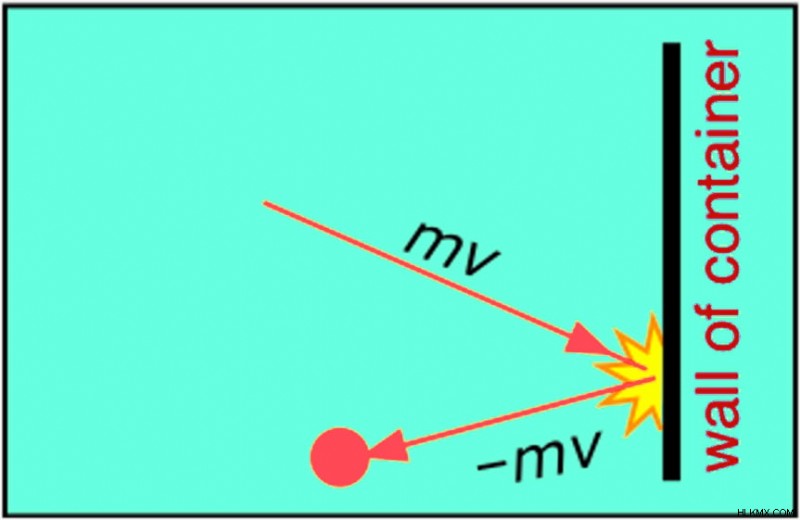
가스 분자는 MV 운동량을 가진 용기의 벽에 부딪칩니다 (M은 분자의 질량이고 V는 그 속도입니다). 음의 부호는 분자가 같은 속도로 반등하지만 벽을 때린 후 반대 방향으로 반등한다는 것을 의미합니다.
반면에 압력은 용기의 벽에 가스 분자에 의해 지역 당 적용되는 힘으로 정의된다. 온도가 상승함에 따라 분자가 용기 벽에 닿는 속도도 증가합니다. 따라서, 온도에 따라, 용기 벽에 가스 분자에 의해 가해지는 힘과 충돌 빈도, 즉 압력도 증가한다.
두 개의 다른 주에서 동일한 가스에 대한 Gay-Lussac의 법칙은
로 제공됩니다.P1/P2 =T1/T2
p1.t2 =t1.p2
게이-루이스 법의 역사
온도와 압력의 관계는 프랑스 물리학자인 Guillaume Amontons에 의해 처음 발견되었습니다. 결과와 결론은 Amontons Drew가 부분적으로 만 정확했습니다. 샘플 가스가 가스의 압력이 냉수 온도와 끓는 물 사이에서 약 1/3 만 증가한다고 결론을 내린 그의 연구와 공기 실험.
정확한 온도계의 가용성 부족으로 인해 부정확성이 발생했습니다. Amontons는 또한 온도가 충분히 감소하면 가스 압력이 완전히 사라질 것이라고 가정했습니다.
1802 년경 100 년이 지난 후 조셉 루이스 게이-루이스 (Joseph Louis Gay-Lussac)는 가스의 거시적 특성 (볼륨 V, 온도 T, 압력 P, 입자 수)에 대한 그의 작업을 발표했다. 공기 온도계를 개발하는 동안 게이-러스는 법에 걸려 넘어졌다.
Gay-Lussac은 압력과 온도의 관계와 함께 또 다른 법을 언급했습니다. 그는``지속적인 압력에서 이상적인 가스의 양은 절대 온도에 직접 비례합니다. '라고 말했습니다. 그러나이 법은 찰스 법으로 알려져 있습니다. Jacques Charles가 비슷한 결론에 도달했지만 출판하지 않았고 Gay-Lussac은 Charles에게 적법한 크레딧을 줄만큼 겸손했습니다.
결론
압력과 온도 사이의 관계는 아몬턴에 의해 처음 발견되었으므로 현재 관계는 일반적으로 아몬턴 법칙으로 알려져 있습니다. Gay-Lussac의 이름은 그가 발견 한 다른 법과 관련이 있습니다. 이 법은 가스를 결합하는 법칙이라고하며, 반응물 가스와 기체 제품의 비율이 정수를 사용하여 어떻게 표현 될 수 있는지 설명합니다. 그러나 일부 학문적 화학 및 물리학 서적은 압력과 온도의 관계를 게이 -Lussac의 법칙으로 계속 식별합니다.







