화합물의 경험적 공식을 계산하려면 화합물에 존재하는 각 요소의 질량을 찾아 두더지로 변환하고 개별 두더지 비율을 계산 한 다음 경험적 공식을 작성하십시오.
화학 화합물의 분자 구조 및 조성에 관한 정보가 전시 될 수있는 여러 가지 방법이있다. 여기에는 일반적으로 사용되는 분자식 공식이 포함됩니다 , 이는 화합물에서 각 원소의 원자 수와 구조식, 를 보여줍니다. 화합물에서 다른 원자의 배열과 결합을 보여줍니다.
화합물에 관한 의사 소통 정보의 또 다른 중요한 형태는 경험적 공식 입니다. . 화합물의 경험적 공식은 가장 간단한 가능한 정수 비율로 화합물을 구성하는 요소를 표시합니다.
경험적 공식을 계산하는 방법?
모든 화합물의 경험적 공식은 몇 가지 쉬운 단계로 결정될 수 있습니다. 절차는 화합물에서 각 요소의 양을 찾고 그 양을 두더지로 변환 한 다음 개별 두더지 비율 계산을 포함합니다. 개별 두더지 비율이 계산되면, 비율은 정수로 변환 될 수 있고 (아직없는 경우) 화합물의 경험적 공식을 작성할 수 있습니다. 그럼에도 불구하고 화합물의 경험적 공식을 계산하기위한 절차를보다 자세히 살펴 보겠습니다.
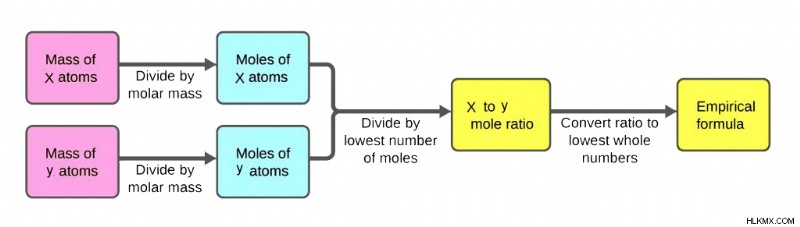
흐름도를 통해 설명 된 경험적 공식 계산
1 단계 :화합물에서 각 요소의 질량 (양)을 찾으십시오.
우리는 연구중인 화합물을 구성하는 각 요소의 정확한 양 (그램)을 찾아서 절차를 시작합니다. 경험적 공식을 찾을 수있는 화합물이 Xaybzc라고 가정 해 봅시다. 화합물 XayBZC의 화학적 분석은 각 요소 (x, y 및 z)의 양에 관한 정보를 백분율 형태로 생성한다. 우리는 100g의 샘플 화합물이 있다고 가정하여 이러한 백분율 값을 간단한 숫자로 변환합니다.
화학적 분석 결과에 따르면 화합물 Xaybzc는 X의 40.0%, y의 6.7% 및 Z의 53.3%를 가지고 있다고 가정 해 봅시다. 샘플 화합물의 100 그램을 가지고 있다면 x가 40g이고 y는 6.7 g이고 Z는 53.3 g입니다.
.화합물의 조성이 백분율 형태로 제공 될 때만이 단계를 수행하면됩니다. 각 요소의 양이 이미 그램으로 제공되는 경우이 단계를 수행 할 필요가 없습니다.
2 단계 :각 요소의 양을 두더지로 변환
2 단계에서는 이전 단계에서 발견 된 질량 값을 사용하여 각 요소의 두더지 수를 찾습니다. 암석 아래에 살고있는 경우, 두더지는 원자, 분자, 전자, 양성자, 중성자 등과 같은 작은 입자의 양을 측정하는 데 사용되는 측정 단위입니다. 요소의 한 두 몰은 요소의 약 6.022 × 1023 원자가 있음을 의미합니다. 그 양에서 요소의 두더지 수를 찾는 공식은 다음과 같습니다.
몰의 수 =존재하는 요소의 양 (그램) / 요소의 몰 질량
우리의 샘플 화합물로 돌아 오는… ( 참고 : 간단한 Google 검색을 수행하여 모든 요소의 어금니 질량을 찾을 수 있습니다.)
두더지의 수는 다음과 같습니다. X의 두더지는 40/12.O1 =3.33 mol; Y의 두더지는 6.7/1.00784 =6.6 mol이고; Z의 두더지는 53.3/15.999 =3.33 mol입니다.
3 단계 :각 요소의 두더지 비율을 계산합니다
이제 화합물에서 가장 적은 수의 두더지가있는 요소를 찾으십시오. 이전 단계에서, 우리는 요소 X와 Z 둘 다 화합물에 3.33 몰을 가지며, Y는 6.66 몰을 갖는다는 것을 알 수 있습니다.
개별 두더지 값을 가장 작은 두더지 값으로 나누어 각 요소의 두더지 비율을 찾을 수 있습니다. 여기서 가장 작은 값은 3.33 몰입니다. 따라서 우리는 다음을 발견합니다.
x/3.33 =3.33/3.33 =1
의 두더지 수y/3.33 =6.66/3.33 =2
의 두더지 수Z/3.33 =3.33/3.33 =1
의 두더지 수4 단계 :두더지 비율을 정수로 변환합니다
절차의 두 번째 단계는 두더지 비율을 정수로 변환하는 것입니다. 우리가 이전 단계에서 찾은 두더지 비율은 1, 2 및 1이며, 모두 정수입니다. 따라서 우리는이 단계를 건너 뛰고 마지막 단계로 진행할 수 있습니다.
그러나 두더지 비율이 정수가 아닌 경우 정수를 곱하면 원하는 값을 제공합니다. 다른 화합물의 두더지 비율이 1.5와 2. 1.5는 정수가 아니며 하나로 변환해야한다고 가정 해 봅시다. 단순히 2를 곱하면 우리에게 정수를 줄 것입니다.
참고 : 비 흰 숫자 두더지 비율뿐만 아니라 모든 두더지 비율을 정수로 곱하십시오.
1.5 x 2 =3 및 2 x 2 =4
5 단계 :경험적 공식을 작성하십시오
이제 우리는 필요한 모든 데이터를 우리 손에 가지고 있으므로 이제 Xaybzc 화합물에 대한 경험적 공식을 작성해야합니다. 화합물에 각 요소의 상징을 기록한 다음 첨자로 두더지 비율을 기록하십시오.
.샘플 화합물의 경우 경험적 공식은 X1Y2Z1 또는 간단히 XY2Z입니다.
최종 단어
우리가 예로 사용한 샘플 화합물 Xaybzc는 실제로 포도당이었습니다. 포도당의 분자 공식은 C6H12O6이지만, 절차의 마지막 단계에서 결론을 내린 것처럼 경험적 공식은 CH2O입니다.

포도당의 분자식 및 경험적 공식
따라서, 경험적 공식은 화합물의 실제 원자 수가 아니라 요소가 존재하는 비율에 관한 정보 만 전달한다는 것을 알 수있다. 실제 에 관한 정보 화합물에 존재하는 원소의 원자 수는 분자식에 의해 제공된다. 화합물의 분자식을 결정하기 위해, 각 요소의 각 요소의 첨자에 경험적 공식의 분자량 대 경험적 공식 질량의 비율을 곱합니다.
.