예, 모든 요소는 고체에서 가스로 직접 전환 할 수 있습니다.
고체, 액체 및 가스의 3 가지 물질 상태가 있다는 것은 상식입니다. 일반적으로 요소는 주변 환경의 변화에 따라 고체에서 액체로 또는 역 순서로 전환됩니다.
그러나 가스 또는 가스에 대한 직접적인 고체를 고체 변화로 가질 수도 있습니다.
그러한 전환을 생각할 때 가장 흔한 요소는 요오드입니다.
초등 교육 전반에 걸쳐, 물질 상태와 관련된 모든 장은 요오드와 나프탈렌에 대해 말하면 가스 전이에 직접 고체 할 수있는 몇 가지 요소 중 하나입니다.
그러나 이것은 실제로 오해입니다.
승화 가란?
승화는 특정 온도 및 압력에서 액체 상을 거치지 않고 고체상에서 기체상으로 원소를 직접 변화시키는 것입니다. 역 프로세스, 즉 가스에서 솔리드로 직접 변경하는 것을 증착이라고합니다.
위에서 언급했듯이 요오드는 승화시킬 수있는 물질의 일반적인 예 중 하나입니다. 다른 것으로 나프탈렌 및 드라이 아이스 또는 이산화탄소가 있습니다. 당신은 나프탈렌으로 만들어진 Mothballs가 시간이 지남에 따라 줄어들고 사라진다는 것을 알았을 것입니다. 그들은 또한 고체 상태에서 직접 가스 상태로 승화하기 때문입니다. 그러므로 그들은 연기로 변환되어‘사라집니다’.

Mothballs는 승화 및 사라지고 (사진 크레디트 :Twenty20)
마찬가지로, 드라이 아이스를 본 적이 있다면, 두꺼운 흰색 연기를 눈치 채지 못하는 것은 불가능합니다. 이것은 다시 한 번 승화의 시각적 예입니다. 드라이 아이스는 이산화탄소의 고형화 된 탄소 일뿐입니다. 실온에서는 가스로 직접 전환되며 볼 수있는 연기는 이산화탄소 가스입니다.
그러나 거의 모든 요소는 올바른 온도 및 압력 조건에서 승화 할 수 있습니다.
위상 다이어그램이란 무엇이며 왜 중요한가?
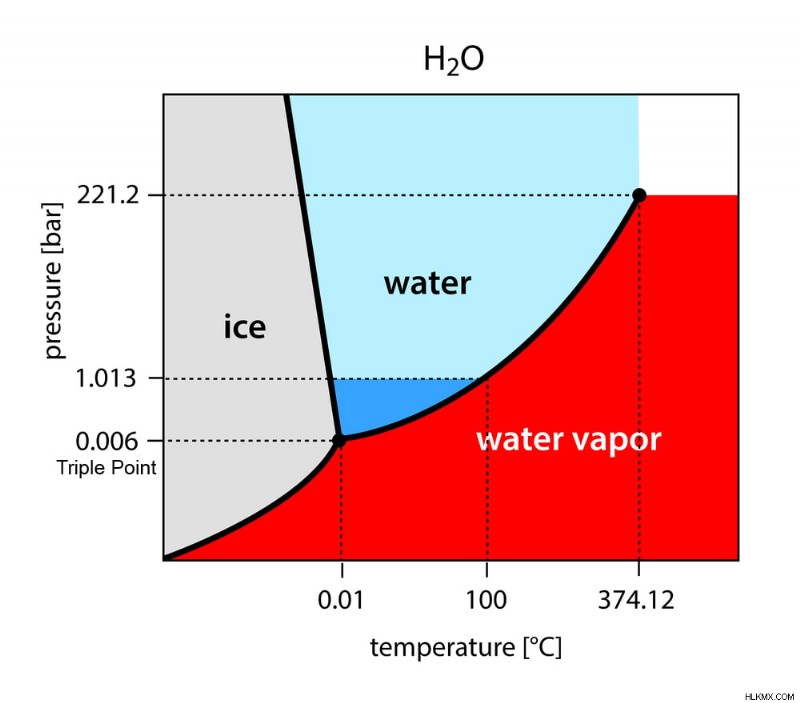
물질의 위상 다이어그램은 각각 X 및 Y 축에 온도와 압력이있는 그래프입니다. 물질의 특정 단계 (고체, 액체 또는 가스)가 존재하고 안정적으로 유지되는 다양한 온도와 압력을 보여줍니다.
다이어그램에는 세 개의 실선이 있습니다. 이들은 다양한 단계가 서로 평형을 이루는 온도와 압력을 보여줍니다. 이 선은 또한 위상 전이가 발생할 때, 즉 물질이 한 단계에서 다른 단계로 변할 때를 나타냅니다. 라인으로 표시된 영역은 3 단계를 보여줍니다. 예를 들어, 아래와 같이 물에 대한 위상 다이어그램을 고려하십시오.
말할 것도없이, 다른 요소에 대한 위상 다이어그램은 다를 것입니다.
위상 다이어그램에서 3 개의 실선은 트리플 포인트로 알려진 한 지점에서 교차합니다. 위에서 언급했듯이 라인은 또한 단계 사이의 평형을 보여줍니다.
따라서 트리플 포인트는 3 단계 (고체, 액체 및 가스)가 서로 평형에 존재할 수있는 지점을 나타냅니다.
(사진 크레딧 :Magnetix/Shutterstock)
트리플 포인트 및 승화
위상 다이어그램에서 볼 수 있듯이 하단의 곡선은 고체와 기체 상태 사이의 전이를 보여줍니다. 액체상은 트리플 포인트 아래에 존재할 수 없습니다. 따라서 트리플 포인트 아래의 어느 시점에서, 대부분의 물질은 가열되면 고체에서 가스로 승화됩니다.
반대로, 트리플 포인트 이상의 어느 시점에서, 우리는 요오드와 이산화탄소와 같은 원소가 액체 상을 통과하는 것을 볼 것입니다.
그러나 대부분의 요소의 경우 트리플 포인트는 정상 온도 및 압력 조건 (NTP) 미만이며, 이는 1 atm의 압력과 ~ 20 ° C의 온도입니다. 이것이 우리가 그들이 승화를받는 것을 볼 수없는 이유입니다. 그러나 물과 같은 물질조차도 트리플 포인트 아래의 조건에 노출 될 때 승화를 겪을 수 있습니다. 물의 경우, 이것들은 0.1 ° C이고 0.006 atm입니다.
이전 예 중 하나를 다시 고려해 봅시다. 이산화탄소 (드라이 아이스)의 트리플 포인트는 ~ 5 atm 및 -56.6 ° C입니다. 드라이 아이스가 가열 될 때 정상 압력, 즉 1 atm에서는 가스 단계로 직접 이동하거나 승화됩니다. 이 예는 온도가 트리플 포인트 온도 미만이 아니더라도 승화가 발생할 것임을 보여줍니다. 이산화탄소의 위상 다이어그램을 볼 때 NTP 조건은 온도가 트리플 포인트 온도의 온도보다 작지만 트리플 포인트 아래에 있습니다. 따라서 트리플 포인트 아래의 에서 승화가 발생한다는 점에 유의해야합니다.
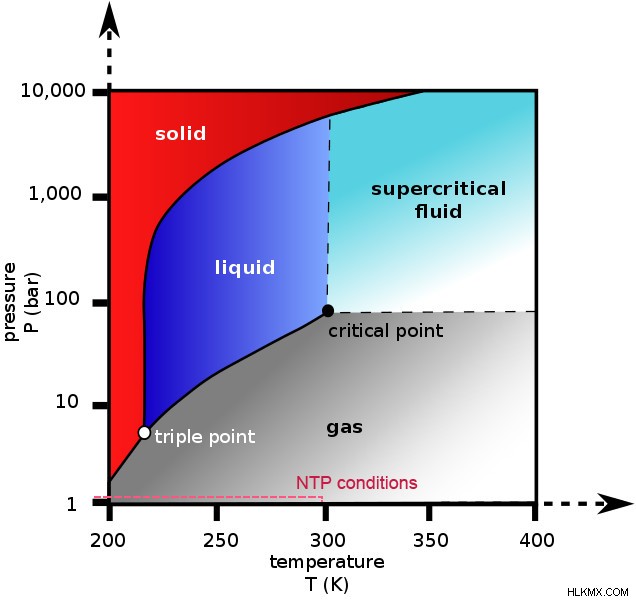
이산화탄소의 위상 다이어그램 (사진 크레디트 :Ben Finne/Wikimedia Commons)
또한 위상 다이어그램은 이상적인 조건에서 적용되므로 평형 상태에서 폐쇄 시스템의 단일 순수한 물질에 적용된다는 점에 유의해야합니다. 이러한 조건은 실제로 충족되지 않으므로 편차가 예상됩니다.
이론적으로 대부분의 요소는 승화를 거칠 수 있지만 이러한 조건을 실제로 달성 할 수는 없습니다. 따라서 실제로 요오드, 나프탈렌 및 이산화탄소와 같은 이상적인 원소를 승화시킬 수있는 요소의 예로 고려하는 것이 가장 좋습니다.