상태를 바꾸는 것이 얼마나 멋진가요?
나를 얼리십시오. 나는 얼음입니다.
나를 가열하십시오. 나는 물이다.
나를 끓여; 나는 증기입니다.
나는 다른 형태와 상태를 가지고있다 : 나는 중요하다!
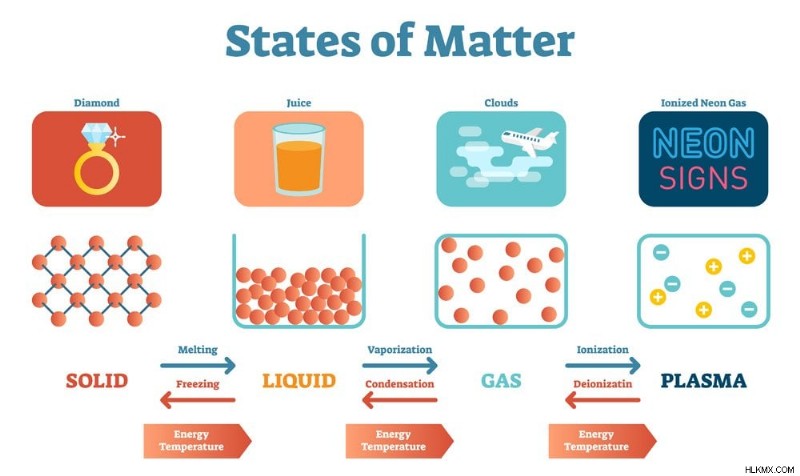
다른 물질 상태 (사진 크레딧 :Vectormine/Shutterstock)
‘ matter’의 다양성
간단히 말해서 matter 의 정의 질량을 운반하고 공간을 차지하는 것입니다.
물질에는 4 가지 기본 사항이 있습니다 :고체, 액체, 가스 및 혈장
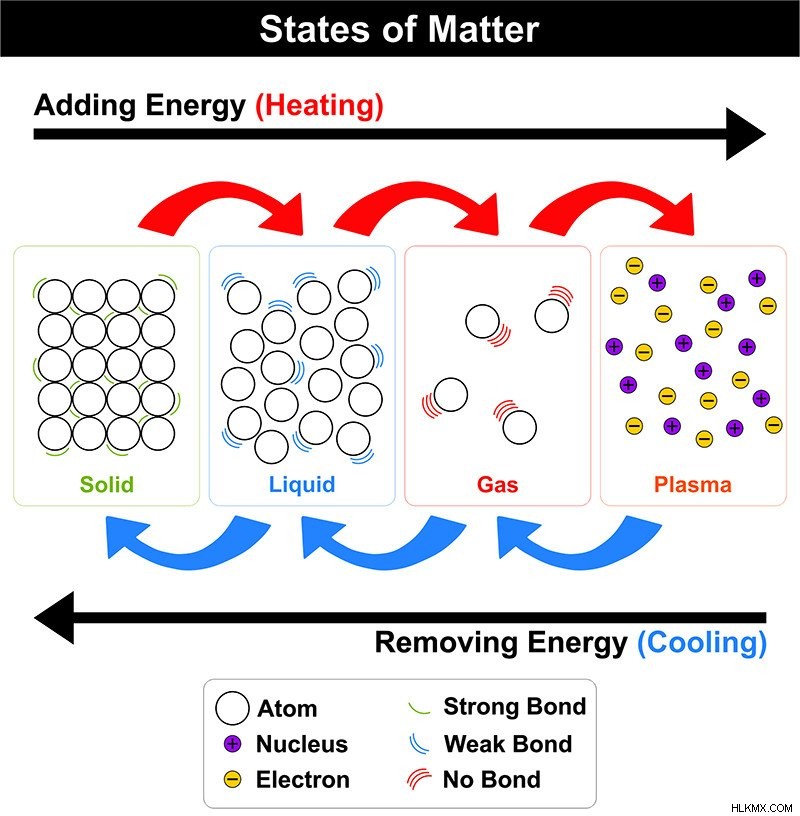
다른 물질 상태에서 분자의 배열 (사진 크레디트 :UDAIX/ShutterStock)
고체 :
이들은 확실한 모양과 부피로 단단하고 압축 할 수 없습니다. 강한 분자간 힘은 분자 간 공간과 함께 분자를 유지합니다. 고체의 분자는 운동 에너지가 낮고 진동 에너지가 낮습니다. 고체는 결정질 또는 비정질.
의 두 가지 형태로 존재할 수 있습니다고체 탄소
액체 :
이들은 유체이며, 명확한 부피, 명확한 모양이 없으며 (용기의 모양을 취함) 압축 할 수 없습니다. 중간 정도의 분자간 힘은 분자간 분자간 공간과 함께 분자를 유지합니다. 액체의 분자는 적당한 운동 에너지로 움직입니다. 액체는 모세관 작용, 점도 및 표면 장력의 특성을 가지고 있습니다.
가스 :

가스의 분자 간 공간 (사진 신용 :Arisa_j/Shutterstock)
이것들은 또한 유동성이 높고, 무기한 모양과 부피를 가지고 있으며, 쉽게 압축 할 수 있습니다. 가스의 분자간 힘은 매우 약하고 분자간 거리가 큽니다. 따라서 가스는 자유롭게 흐르고 가스의 분자는 높은 운동 에너지로 이동합니다.
혈장 :
우주에서 가장 풍부한 물질 상태는 혈장 또는 과열 물질입니다. 우주의 물질의 99%는 혈장 상태에 있습니다. 에너지가 중성 가스를 통과 할 때, 전자는 제거되어 긍정적이고 음으로 하전 된 이온을 형성합니다. 모양도 부피가 없습니다. 혈장은 태양과 별을 구성합니다.

(사진 크레딧 :Quardia/Shutterstock)
물질 상태에 대한 온도의 영향 이해
대기압에서, 물은 0 ℃에서 100 ℃ 사이의 온도에서 액체로, 100 ℃를 넘어 물 증기 (가스), 0 ℃ 이하의 얼음 (고체)으로 존재한다. 특정 상태에 물질이 존재하는 온도 범위는 각 물질마다 다릅니다.
우리는 물이 세 가지 상태를 가지고 있다는 것을 알고 있지만 다른 요소와 화합물은 어떻습니까? 철, 산소 및 염화 칼슘이 세 상태에 존재합니까?
강조 대답은 다음과 같습니다.“모든 문제는 온도와 압력에 따라 다른 상태에 존재합니다”.
상기로부터 산소는> -182 ℃의 가스이며, 철은 2860 ℃에서 가스이다. 모든 문제는 세 상태에 존재할 수 있지만 각 주에 달성하는 온도는 크게 다릅니다.
찰스의 법은 물질의 상태를 지배합니다
Charles의 법률은 압력이 일정하게 유지되면 고정 된 양의 가스 양이 절대 온도에 직접 비례한다고 말합니다.
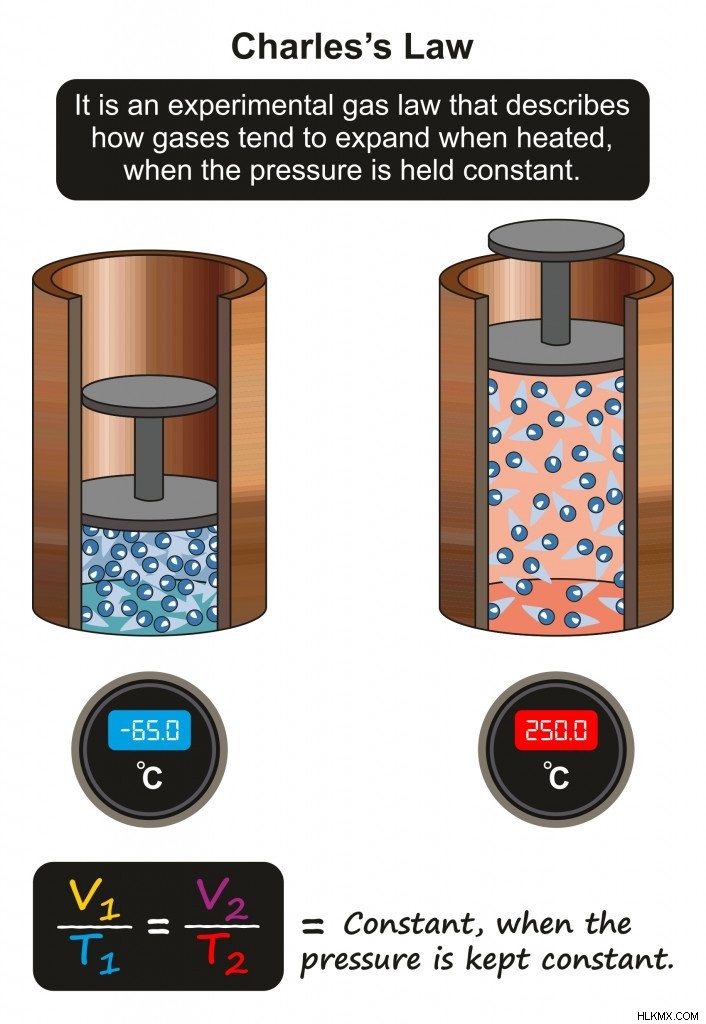
온도와 부피의 관계를 가정하는 Charles 's Law (사진 크레디트 :Udaix/Shutterstock)
일정한 압력에서, 고체 (즉, 얼음)의 온도가 증가하면 부피가 증가합니다. 부피가 증가함에 따라 분자는 더 멀리 이동하여 분자 간 거리를 증가시켜 분자간 힘을 감소시킵니다. 이런 일이 발생하면 단단한 얼음은 천천히 액체 물로 위상 전이를 겪습니다.
온도가 추가로 증가하면 부피가 비례 적으로 증가하여 분자가 서로 멀리 떨어져 있습니다. 이것은 분자간 거리를 증가시키고, 매력 간 힘을 감소시켜 물 (액체)에서 증기 (가스)로 이동합니다.
.물질 상태에 대한 압력의 영향 이해
앞에서 언급했듯이 압력은 물질 상태를 결정하는 또 다른 중요한 요소입니다. 이 원리는 액체 N2 및 드라이 아이스 (고체 이산화탄소)의 제조에 사용됩니다. 가스에서 압력이 증가하면 기체 질소가 액체가 될 것입니다.
반면에 압력을 충분히 줄여 실온에서 물을 끓일 수 있습니다.
따라서 압력과 온도는 역 관계에 있습니다. 액체 N2 및 드라이 아이스는 가스 N2 및 CO2에 압력을 가스에서 액체로, 가스로, 고체로 각각 변경하여 제조됩니다.

액체 N2 (사진 크레딧 :Suslov Denis/Shutterstock)

드라이 아이스 (사진 크레딧 :Kollawat Somsri/Shutterstock)
Boyle의 법은 물질의 상태를 지배합니다
앞에서 언급했듯이, 압력과 온도 사이에는 역 관계가 있으며, 이는 Boyle의 법칙에 의해 지배됩니다. 법에 따르면, 일정한 온도에서 압력이 감소함에 따라 가스의 부피가 증가합니다.
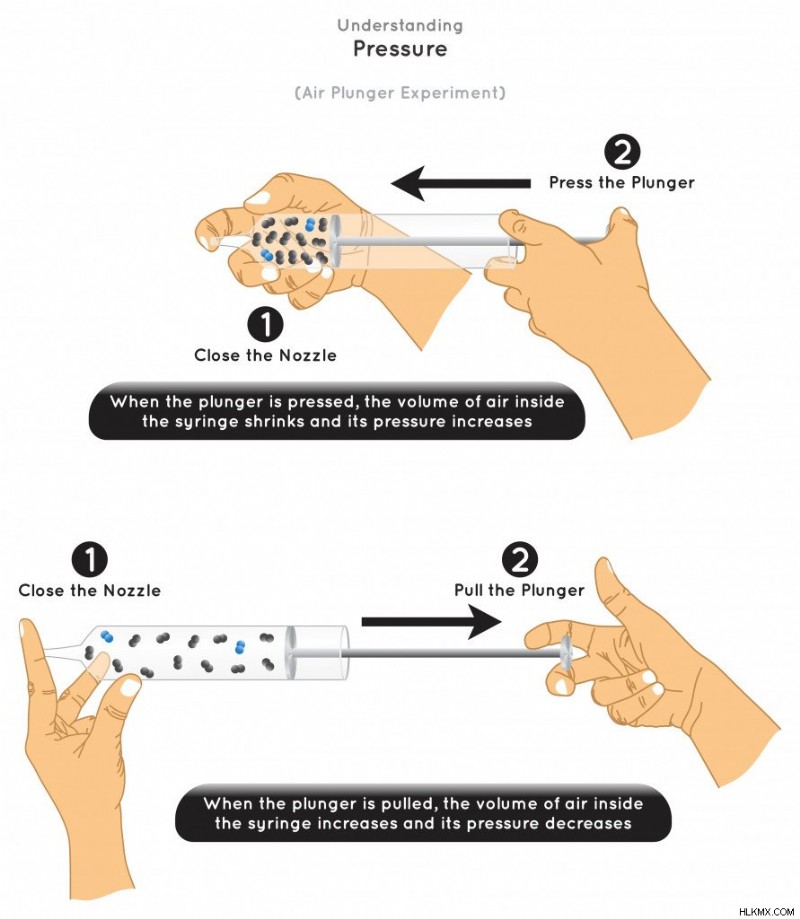
Boyle 's Law 압력과 음량의 관계를 가정하는 (사진 크레디트 :Udaix/Shutterstock)
위의 예에서, 우리는 가스의 압력과 부피가 반비례 적으로 비례한다는 것을 관찰합니다.
압력이 증가하면 부피가 감소하여 분자를 더 가깝게 만듭니다. 이것은 분자간의 인력을 증가시키고 분자간 거리를 감소시킵니다. 이것은 기체에서 액체 상태로의 전환을 촉진합니다.
압력이 더욱 증가하면 부피가 더욱 줄어들어 액체를 고체로 전달합니다.
드라이 아이스는 어떻게 형성됩니까?
드라이 아이스 제조에서 CO2 가스 압력은 1 대기 (1 atm)에서 5.11로 감소합니다. 이 압력과 일정한 -56 ℃에서 기체 CO2는 매우 일시적인 액체 상태로 고체 CO2가됩니다.
물질의 세 가지 상태가 평형 상태에있는 특정 온도와 압력을 트리플 포인트라고합니다.
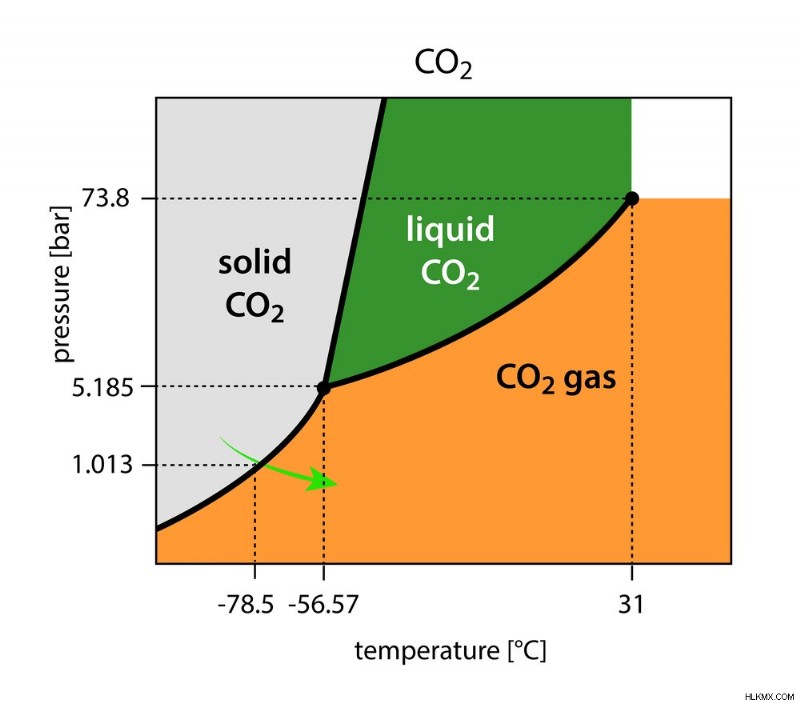
트리플 포인트 :순수한 물질의 고체, 액체 및 증기 상이 평형에서 공존 할 수있는 온도 및 압력 (사진 신용 :Magnetix/Shutstock)
온도가 약간 감소하면 위상 가스 CO2가 고체 CO2로 변환됩니다.
결론
물질 상태는 지속적으로 재활용되며 온도와 압력은 위상 전이를 제어합니다. 모든 상태가 공존하는 온도와 압력을 트리플 포인트라고합니다. 온도, 부피 및 압력 사이에 미세한 조정 된 공정 물질의 상태를 결정합니다.