Niel Bohr의 원자 이론에 따르면 - 원자는 전자가 개별적으로 활력을주는 궤도에 위치한 행성 모델과 같습니다. 흥분된 전자가 더 높은 궤도에서 하부 궤도로 점프 할 때 원자는 광자를 방출합니다. 그 궤도의 에너지 사이의 차이는 광자의 에너지와 동일합니다.
Niels Bohr는 덴마크 물리학 자였으며 양자 역학의 창시자 중 한 명으로 여겨지며 정확하게 old 양자 역학. Carlsberg Brewing Company는 과학에 대한 모범적 인 기여를 위해 양조장 바로 옆에 위치한 집을 주기로 결정했습니다. 집은 파이프 라인으로 양조장에 연결되었습니다. 보어는 자신의 변덕에 탭에서 쏟아 질 수있는 평생 무료 맥주 공급으로 보상을 받았다. Niels Bohr는이 권위있는 영광을받을 자격이 있었고, 노벨상을받을 자격이 있었습니까?

Niels Bohr. (사진 크레딧 :공개 도메인 / 위키 미디어 커먼즈)
간단히 말해서, Niels Bohr는 원자의 신비한 내부 작업을 밝혔습니다. 비록 그가 원자 핵의 8 월 창립자 인 어니스트 러더 포드 (Ernest Rutherford)와 공동으로 자신의 모델과 원칙에 도달했지만,이 모델은 Bohr에게만 적용됩니다. 원래 Rutherford-Bohr Atomic Model이라고 불리는 것은 일반적으로 Bohr의 원자 모델이라고합니다.
Bohr의 이론을 이해하려면 먼저 이전의 발견이 그의 혁신적인 아이디어를 추구하게 한 것을 이해해야합니다.
Rutherford의 실패 모델
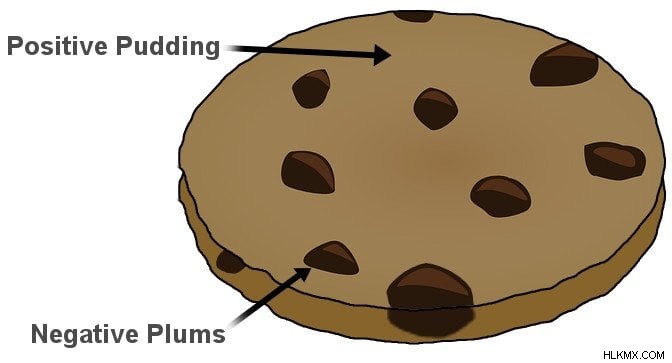
J.J. 원자가 결국 불가능하다는 것을 처음 발견 한 Thomson은 수세기 동안 사실이라고 생각되는 개념입니다. 그러나, subatomic 그가 발견 한 입자는 음으로 하전되었습니다. 만약 원자가 단지 음전하의 클러스터라면, 의자, 테이블, 당신과 나는 안정적이지 않을 것입니다. 그는 물질의 안정성을 설명하기 위해서는 부정성을 중화하기 위해 순 양적 전하가 있어야한다는 것을 즉시 깨달았습니다.
Thomson은 원자의 첫 번째 모델이 된 것을 고안했습니다. 그는 전자라고 불리는 음의 입자는 긍정적으로 하전 된 수박에 내장 된 씨앗과 같다고 제안했다. 이 모델은 Plum 으로 널리 알려져 있습니다 또는 Raisin Pudding 모델 . 나는 비유가 분명하다고 확신한다.
어니스트 러더 포드 (Ernest Rutherford)가 양의 입자가 원자에서 촬영 될 때 대부분의 경우 똑바로 지나가지 만, 일부는 큰 각도로 편향되는 것으로 관찰 될 때 까지이 견해는 사실이었다. 러더 포드는 대부분의 원자가 빈 공간으로 채워져 있음을 깨달았지만 중앙에서는 밀도가 높고 포인트와 같은 양전하가있었습니다. 그는 이것을 원자의 핵이라고 불렀다. 원자의 전자와 그 핵 사이의 빈 공간의 양은 너무 커서 원자가 야구 경기장의 크기로 확장되면 핵은 야구의 크기 일 것입니다.
Rutherford는 아마도 원자계가 우리 태양계와 유사하다고 제안했으며, 여기서 전자는 태양 주위를 돌고있는 행성처럼 핵 주위를 돌고 있습니다. 물론 중요한 차이는 전자가 중력보다는 정전기력에 의해 사로 잡혀 있다는 것이었다. 그러나 Maxwell과 Hertz는 격렬하게 동의하지 않았을 것입니다.

러더 포드의 행성 모델.
Maxwell의 전자기 법칙은 최근 전자와 같은 하전 입자의 운동이 에너지를 희생 시킨다는 것을 최근에 확립했습니다. 따라서, 구 안에서 주위를 경주하는 오토바이의 서커스 남자와 같은 회전 전자는 연료가 부족하면서 곧 나선형으로 붕괴 될 것입니다. 실제로, 물리학 자들은 전자가 모든 에너지를 방출하고 핵으로 붕괴시키기 위해 전자가 16 개의 피코 초만 걸릴 것이라고 계산했습니다. 그것은 1 조 1 초입니다. 물질의 심오한 안정성을 설명 할 새로운 원자 모델은 아직 발견되지 않았다.
수소 스펙트럼
당시에 당황한 물리학자를 당황시킨 또 다른 부조리는 Planck의 흑체 방사선과 다른 원자에 의해 제공되는 "방출 스펙트럼"이었다. ‘스펙트럼’이라는 단어는 뉴턴이 처음으로 만들어 져 그의 프리즘에서 나온 색의 무지개를 묘사했습니다.
마찬가지로, 신체가 가열되면, 전자기 에너지의 스펙트럼을 발산합니다. Blowtorch로 철제 막대를 태우면 막대의 온도가 증가함에 따라 가정하는 색상도 점차 변할 것임을 알 수 있습니다. 첫째, 바이올렛을 향해 늘리기 전에 빨간색, 오렌지, 그리고 밝은 흰색입니다.
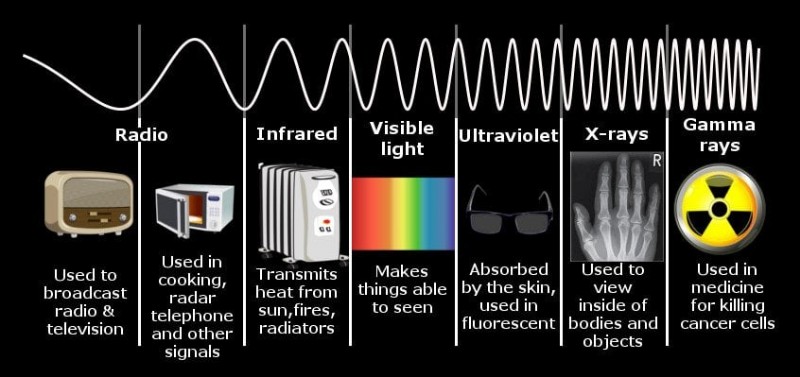
전자기 스펙트럼.
철 막대에 의해 방사되는 전자기 에너지가 눈에 띄는 빛의 범위에 속하기 때문입니다. 막대를 20,000 켈빈으로 가열한다면 에너지는 자외선 (UV) 범위에 있습니다. 실제로, 우주의 모든 물체는 인간을 포함한 그러한 스펙트럼의 에너지를 발산하지만, 우리 몸의 온도가 너무 낮기 때문에 방출 된 에너지는 적외선의 어딘가에도 빈약합니다. 우리의 눈에는 전자기 스펙트럼의 여러 멤버 중 한 명만 식별 할 수있는 센서가 장착되어 있습니다.
Max Planck는이 현상 흑체 방사선을 불렀습니다. 빛의 파장을 방사하여 열 강도를 플로팅하려면 특정 범위의 파장에서 피크를 관찰 할 수 있습니다. 6,000K에서 태양의 핵심 연소의 피크는 가시 범위에 부분적으로 위치하며, 20,000K에서 타는 별의 경우 UV 범위에 완전히 있으며 블랙홀의 탄생과 같은 별 폭발의 경우 감마 범위에 있습니다.
.
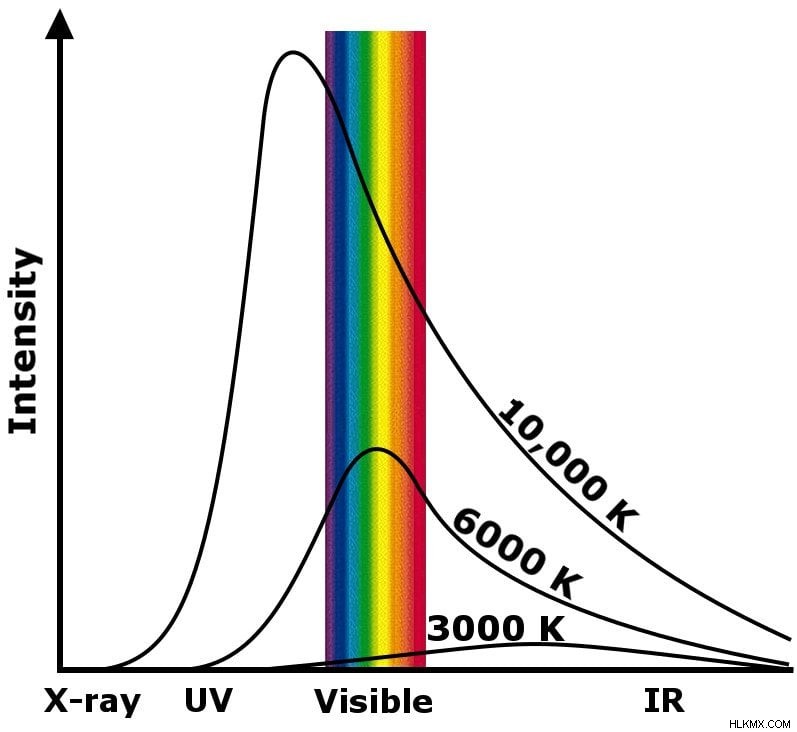
흑체 방사선
또한, 그래프는 신체의 온도가 감소함에 따라 빛의 파장이 증가한다는 것을 묘사합니다. 예를 들어, 빅뱅의 방사선은 감마선으로 시작되었을 수 있지만, 130 억 년이 넘게 냉각되면서 파장은 전자 레인지로 길어졌습니다. 이 파도를 검은 색 배경으로 음모하려면 아름답고 흐릿한 색상의 색상을 목격 할 것입니다 - 연속 스펙트럼.

연속 스펙트럼. (사진 크레딧 :STKL / Wikimedia Commons)
그러나 Planck의 발견의 주요한 의미는 방사 된 에너지가 강성 입자와 같은 개별 패킷으로 이동하여 아인슈타인이 나중에 광자라고 불렀다는 것입니다. 단일 양자 의 에너지 파장에 반비례하거나 주파수에 직접 비례합니다. Planck 's Constant라는 비례의 기본 상수, h , 에너지 e 주파수 v 의 경우 e =hv. 으로 표현 될 수 있습니다
이제, 이런 식으로 단일 요소의 가스 부피를 가열하고 검은 색 배경으로 색상을 플로팅한다면, 당신은 이상을 관찰 할 것입니다. 스펙트럼은 더 이상 아름답거나 연속적인 색상 혼합이 아닙니다. 대신, 그것은 절대적으로 검은 색 배경의 덩어리에 의해 간헐적으로 분리 된 일련의 확실한 단일 색상 라인을 포함합니다. 예를 들어, 끊임없이 유명한 수소를 살펴보십시오.

수소의 스펙트럼. (사진 크레디트 :Patrick Edwin Moran / Wikimedia Commons)
실제로, 우주의 모든 요소는 고유하고 불연속적인 스펙트럼을 그립니다. 수소의 스펙트럼은 가시 범위에 있지만 특정 요소는 자외선 또는 적외선 범위에있는 스펙트럼을 생성합니다. 이러한 이유로 요소의 스펙트럼은 지문으로 간주됩니다. 독창성에 대한 지식은 우리가 별의 구성을 연구 할 수있게 해주 었으며 심지어 과학자들도 새로운 요소를 발견하는 데 도움이되었습니다!
수소의 스펙트럼을 살펴보면 특정 주파수 (이러한 색상과 관련된 특정 주파수만이 방사 되었기 때문에 특정 색상 만 나타났습니다. 그 점을 감안할 때, 왜 원자가이 독특한 행동을 나타낼까요? 어떤 원자 구조가 그렇게 심하게 제한되어 자신을 그렇게 심하게 표현할 수 있습니까? 1913 년 Niels Bohr는 마침내 그 이유를 깨달았습니다.
Bohr 's Atomic Model
Bohr는 Rutherford의 태양계 모델을 계속 진행했지만 약간의 조정을 추가했습니다. 그는 전자가 고정 또는 명확한 궤도에서 핵 주위에 회전한다는 것을 제안함으로써 실패한 측면을 바로 잡았다. 그는이 궤도에서 전자가 에너지를 잃지 않아서 핵으로 붕괴되지 않았다고 주장했다.
Bohr는 이러한 고정 궤도를“고정 궤도”라고 불렀습니다. 그는 궤도가 무작위로 위치한 것이 아니라 중앙의 핵과 분리 된 거리에 있었고 각각 고정 에너지와 관련이 있다고 주장했다. Planck의 이론에서 영감을 얻은 그는 궤도를 n, 로 표시했습니다. 그것을 Quantum이라고 불렀습니다 번호 .
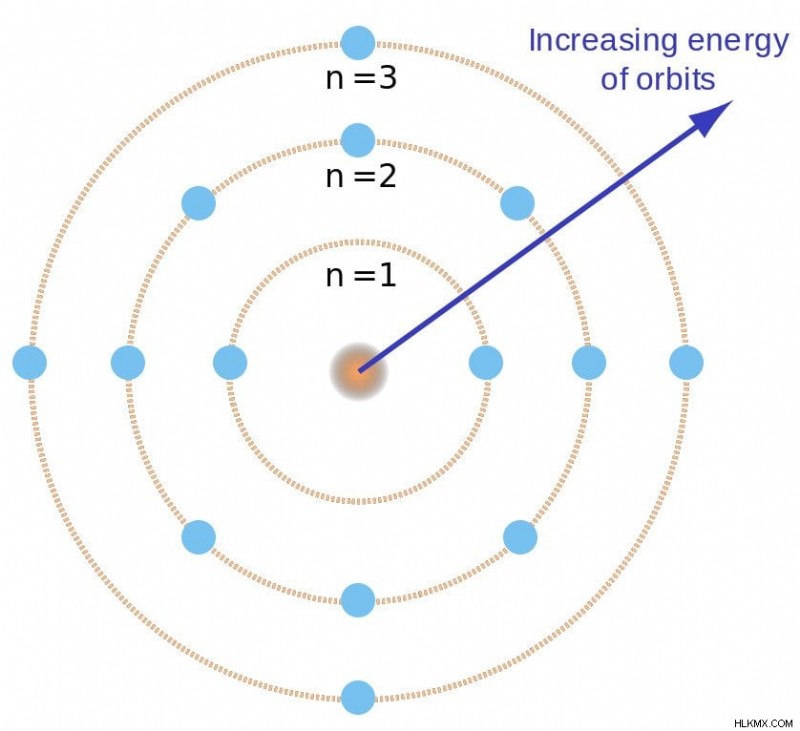
보어의 고정 궤도. (사진 크레디트 :Brighterorange / Wikimedia Commons)
그러나 터무니없는 이론이 나타 났을 수도 있지만, 수소의 스펙트럼을 화려하게 예측했다. 이에 따르면, 가스가 가열되면, 에너지 전자는 낮은 에너지의 궤도에서 더 높은 에너지 궤도로 점프합니다 (수소의 경우 n =1에서 n =2까지). 그러나 안정성을 회복하려면 더 낮은 에너지 궤도로 돌아와야합니다. 이 전환을 겪는 동안 전자는 에너지의 일부를 잃어야하며,이 에너지는 빛의 형태로 방사되는 에너지입니다!
궤도의 불연속 특성은 광자의 개별 특성에 대한 간결한 설명을 제공합니다. Bohr는 방출 된 광자의 에너지가 전자가 점프하는 두 수준의 에너지의 차이와 같다는 것을 발견했다. 예를 들어, 전자가 짧은 도약을 할 때 적외선이 방사되며, 자외선은 훨씬 더 큰 도약을 할 때 방사됩니다. 이 관계는 단순히 e2 - e1 =hv. 로 표현 될 수 있습니다. 반대로, 전자는 광자를 흡수 할 때 더 높은 궤도로 점프합니다.
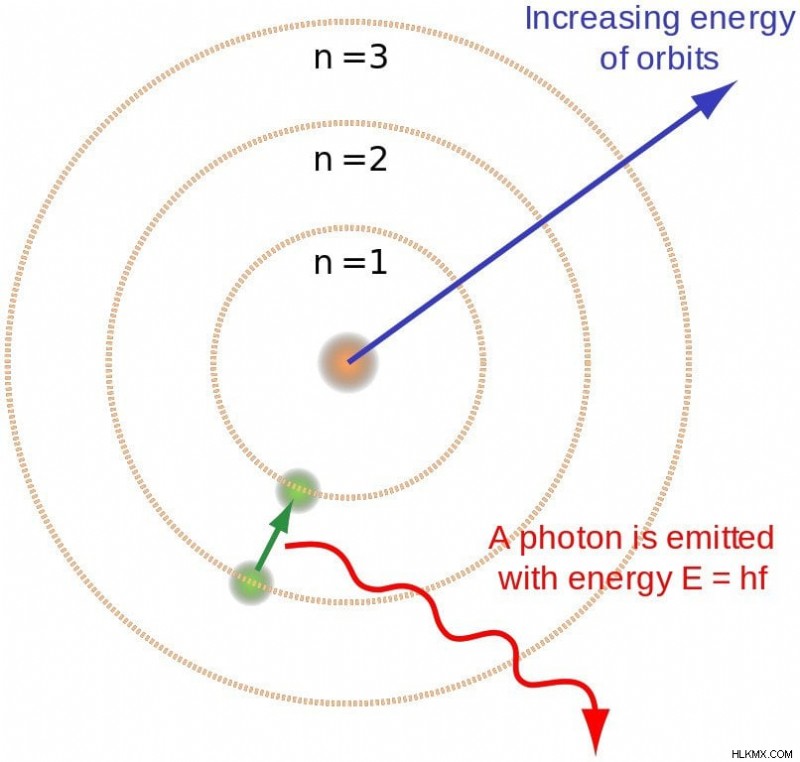
전자가 더 높은 궤도에서 낮은 궤도로 내려 오면 광자는 방출됩니다. (사진 크레디트 :Brighterorange / Wikimedia Commons)
콘크리트, 조직화 된 구조는 전자가 특정 에너지 전이 만 허용하기 때문에 원자의 스펙트럼은 특정 색상으로 제한됩니다. 이제 수소 원자에 단일 전자 만 포함 된 경우 스펙트럼이 왜 여러 색상으로 구성됩니까? 글쎄, 이것은 가스가 근처의 것보다 더 높거나 낮은 다른 궤도로 전자를 올린 수백만과 수십억의 원자로 구성되기 때문입니다.
따라서 이것은 Bohr의 모델이었습니다. 전자가 개별적으로 활력을주는 궤도에 위치한 행성 모델입니다. 흥분된 전자가 더 높은 궤도에서 하부 궤도로 점프 할 때 원자는 광자를 방출합니다. 그 궤도의 에너지 사이의 차이는 광자의 에너지와 동일합니다.
단점
불행히도, Bohr의 모델은 두 개의 충전 지점이 서로 궤도를 선보이는 시스템의 동작 만 설명 할 수있었습니다. 이것은 특히 수소 원자를 의미했습니다. 또한 이온화 된 헬륨 (헬륨에는 2 개의 전자가 있으므로 이온화는 그 중 하나를 압수하여 하나만 남겨두고 이중 이온 리튬 (리튬이 3 개의 전자를 가지고 있습니다… 수학을합니다)을 포함합니다. 그의 이론은 수소를 제외한 다른 원자의 행동을 설명 할 수 없었습니다.

Bohr의 모델은 충전 된 두 지점이 서로를 돌리는 시스템의 동작 만 설명 할 수있었습니다. 이것은 특히 수소 원자를 의미했습니다. 특히
또한, 그의 이론은 전자가 스레드의 비드와 같은 고정 궤도에 정렬되며, 이는 전자의 비 중 활성화 시스템을 가정했음을 의미한다고 지시했다. 이것은 끔찍하게 2 개가 아니라 다중 전자 사이의 폭력적으로 반발하는 정전기 힘을 함께 할인하여 서로 멀어 질 수있는 여러 전자가 모여 있습니다. 결국, 우리는 전자가 회전하는 것뿐만 아니라 축에서 회전하거나 회전한다는 것을 발견했습니다. Bohr의 모델은 왜 이것이 에너지 손실로 이어지지 않았는지 설명 할 수 없었습니다.
Bohr의 이론이 쉽게 받아 들여진 이유 중 일부는 그것이 관찰되지 않은 다중 스펙트럼의 이론적 예측을 성공적으로 만들었습니다. 그럼에도 불구하고 현대 양자 역학을위한 길을 열어 현대 물리학에 혁명을 일으키기 때문에 그것은 널리 찬사를 받고 있습니다. 결국, 현대 양자 역학은 에너지 껍질의 진정한 특성, 전자가 각각에 거주하는 방법, 그리고 스핀의 문제를 완벽하게 설명했습니다.
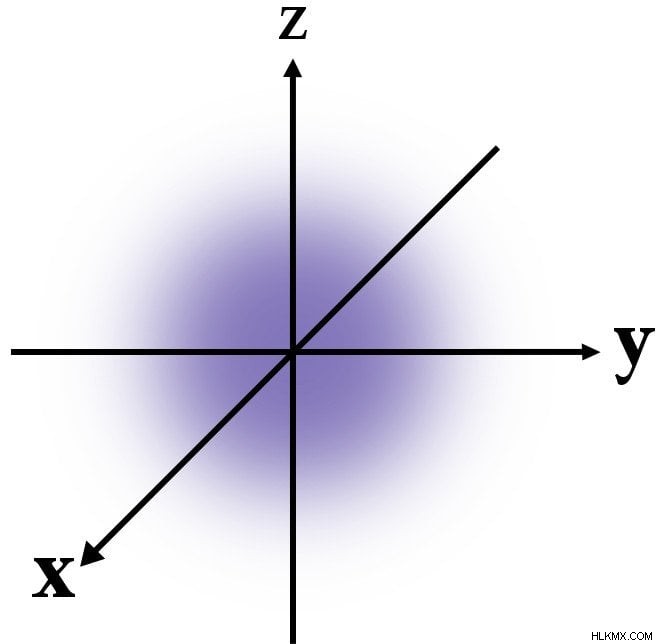
양자 역학에 따르면, 에너지 쉘에서 전자의 정확한 위치를 결정할 수 없습니다. 다소 더 가능한 입니다 껍질에서 찾을 수 있습니다. 여기에는 중앙으로 이동함에 따라 파란색의 밀도가 점차 증가하는 최초의 에너지 쉘이 표시됩니다. 전자가 가장 가능성이 높다는 것을 보여줍니다 핵 근처에서 발견됩니다.
그러나 단순화를 위해 Bohr의 아이디어는 여전히 계속 존재하며 고등학교 물리학을 지배합니다. 교과서는 핵을 둘러싼 전자로 채워진 동심원으로 가득 차 있으며, 이는 비드 스레드 모델과 유사합니다. 그의 공헌으로 Bohr는 반드시 그 무료 맥주를 마땅히 받아야했습니다. 그리고 물론… 노벨상.