화학 화합물의 경험적 공식 또는 가장 간단한 공식은 분자를 구성하는 요소의 가장 간단한 비율입니다. 이 비율은 요소 기호 옆의 첨자로 표시됩니다. 이 예제 문제는 화합물의 경험적 공식을 결정하는 단계를 안내합니다.
예 :과산화수소의 분자식은 H 2 입니다. o 2 . 이것은 하나의 과산화수소 분자에 2 개의 수소 원자와 2 개의 산소 원자가 있음을 의미합니다. 이 요소들 사이의 비율은 1 :1입니다. 분자에 존재하는 모든 수소 원자에 대해, 하나의 산소 원자가있다. 과산화수소의 경험적 공식은 ho.
입니다
예제 문제 :
화합물의 샘플은 63.5%은, 8.2% 질소 및 28.3% 산소를 함유하는 것으로 밝혀졌다. 이 화합물의 경험적 공식은 무엇입니까?
솔루션 :
1 단계 : 샘플 100 그램이 있다고 가정하십시오. 이를 통해 주어진 % 조성물로부터 화합물의 각 요소에 대한 그램의 양을 더 쉽게 결정할 수 있습니다.
화합물의 100 그램에는 다음과 같습니다.
63.5 그램의은
8.2 그램의 질소
28.3 그램의 산소
2 단계 : 이 무게를 두더지로 변환하십시오.
주기적인 테이블을 사용하여 각 요소의 원자량을 얻으십시오.
은 :107.87 g/mol
질소 :14.01 g/mol
산소 :16.00 g/mol
각 요소의 두더지 수를 얻으려면 샘플 중량을 원자량으로 나눕니다.
은:

질소:
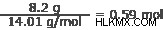
산소:
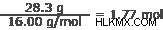
3 단계 : 이 값 사이의 가장 작은 정수 비율을 결정하십시오.
시작하기 가장 좋은 곳은 가장 적은 수의 몰을 찾는 것입니다. 이 경우 0.59 몰에서은과 질소입니다. 각 요소의 금액을이 숫자로 나눕니다.
은:
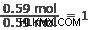
질소:
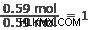
산소:
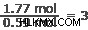
은의 모든 몰에는 1 몰의 질소와 3 몰의 산소가 있습니다.
경험적 공식은 Agno
답변 :
이 화합물의 경험적 공식은 agno