중화 반응 산과 생성물로 소금과 물을 형성하는 염기 사이의 화학 반응입니다. 다시 말해, 반응은 산과 염기를 중화시킨다. 중화 반응은 반응물이 산 및 염기 인 이중 대체 반응의 한 유형입니다.
산은 물에서 수소 이온을 방출하는 반면, 염기는 수산화물을 방출한다. 수소와 수산화수소는 물을 결합하고 물을 형성하는 반면, 산의 음이온은 염기의 이온 성 화합물을 형성합니다. 중화는 산과 염기가 물에 적어도 부분적으로 용해되는 경우에만 발생합니다. 반응의 산물 인 소금은 가용성이거나 침전물을 형성 할 수 있습니다.
강한 산 및 강한 염기가 완전히 반응하면, 결과는 중성 pH (pH ~ 7.0)를 갖는 수용액이다. 그러나 많은 중화 반응은 pH 값이 낮거나 높은 솔루션을 초래합니다.
산-염기 중화 반응
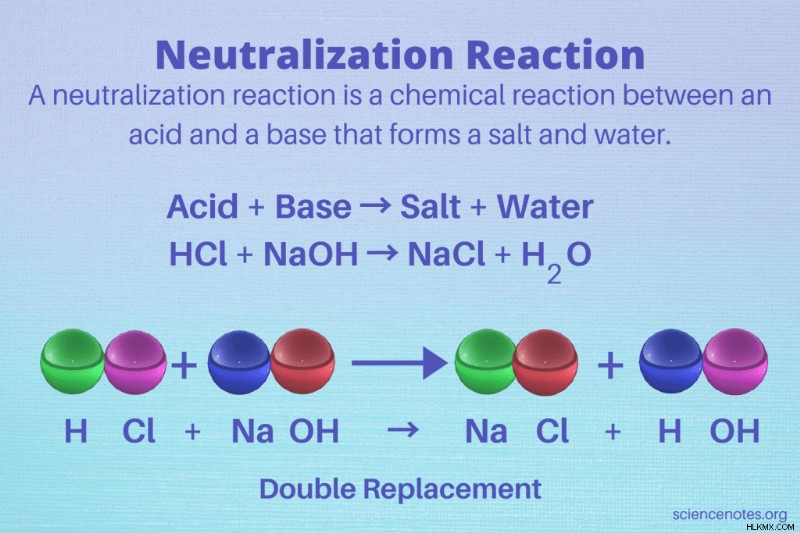
일반적으로, 중화 반응은 산과 염기 (알칼리) 사이의 이중 대체 반응의 한 유형이다. 반응의 일반적인 형태는 산과 염기 반응이며 소금과 물을 형성합니다.
산 + 염기 → 소금 및 물
예를 들면 :
HCL + NAOH → NACL + H 2 o
또는 반응을 이온 방정식으로 쓸 수 있습니다.
H (aq) + cl (aq) + na ( AQ) + OH (AQ) → NA (AQ) + CL (aq) + h 2 o (l)
관중 이온을 취소하면 순 이온 방정식은 다음과 같습니다.
H (aq) + OH (aq) → H 2 o (l)
반응 화살표가 오른쪽을 가리키고 반응이 전방 방향으로 만 진행됨을 나타냅니다.
.
Brønsted – Lowry Acid -Base 이론에 기초한 반응의 일반적인 형태는 다음과 같습니다.
AH + B → A + BH
강산 - 강한 염기 중화
강산 및 강한 염기는 물에 완전히 분리되어 반응하여 중성 수용액에서 중성 염을 형성합니다. 최종 pH 값은 약 7이지만 온도에 따라 약간 높거나 낮을 수 있습니다.
가장 일반적인 강산과 염기는 다음과 같습니다. 그들이 서로 반응 할 때, 최종 pH 값은 7의 최종 pH 값을 기대합니다. 대부분의 다른 산과 기초는 7 이외의 pH를 산출합니다.
| 강산 | 강한베이스 |
| hcl | lioh |
| hbr | naoh |
| hi | koh |
| hcio 4 | rboh |
| hno 3 | csoh |
| | ca (OH) 2 |
| | sr (OH) 2 |
| | ba (OH) 2 |
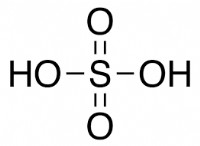
황산 (H 2 그래서 4 )는 두 개의 수소 원자가 있기 때문에 다른 강산과 다르게 행동합니다. 황산은 완전히 분리되지만 단계적으로 그렇게합니다.
약산 - 약한 염기 중화
약산과 약한 염기는 물에 완전히 분리되지 않습니다. 대신에, 평형 혼합물은 약산 및 그의 접합체 염기 및/또는 약한 염기 및 그의 접합체 산을 함유하는 형성이 형성된다.
.
AH + B + A + BH
두 종은 서로 완전히 중화되지 않습니다. 약산과 약한 염기 사이의 중화 반응의 pH 값은 약산 및 염기의 강도에 의존한다. ka =kb 인 경우에만 pH는 7입니다. 약한 염기가 더 강한 경우 (kb> ka), 최종 용액은 알칼리 (pH> 7)입니다. 약산은 더 강하고 (ka> kb), 최종 용액은 산성이다 (pH <7).
약산 및 강한 염기
약산과 강한 염기 사이의 중화 반응의 최종 pH는 약산의 강도에 달려 있습니다.
ah + h 2 o 3 h 3 o + a
강산 및 약한 염기
강산과 약한 염기 사이의 중화 반응의 최종 pH는 염기의 산 해리 상수, pka.
에 의존한다.
H 3 o + b 2 o + bh
pH 값 예측
중화 반응의 pH는 반응물의 특성에 따라 다릅니다.
| 산 및 기본 강도 | pH |
| 강산 - 강한 염기 | 7 |
| 강산 - 약한 염기 | <7 |
| 약산 - 강한 염기 | > 7 |
| 약산 - 약한 염기 | pH <7 인 경우 KA> KB
ka =kb 인 경우 pH =7
ka 인 경우 pH> 7 |
pH가 약한 염기와 강한 산을 반응하고 강한 염기와 약한 산을 높은 반응하는 이유는 입니다. 강한 산 또는 강한 염기 때문에. 대신, 생성 된 염이 pH에 영향을 미치기 때문입니다. 약산의 컨쥬 게이트 염기는 용액을 알칼리성으로 만듭니다. 약한 염기의 컨쥬 게이트 산은 용액을 산성으로 만듭니다.
중화 산물을 예측하는 방법
중화 반응에 대해 학생들이 얻는 두 가지 일반적인 질문은 반응의 생성물과 최종 pH가 산성, 알칼리 또는 중성인지 여부를 예측하고 있습니다.
- 반응물을 식별하십시오. 강산과 강한 염기 사이의 반응입니까, 아니면 약산 또는 약한 염기가 있습니까? 강한 산-강한 염기 반응은 염과 물을 형성하고 pH는 7입니다. 약산 또는 약한 염기가 존재하는 경우, pH는 산 또는 염기가 더 강한 지에 따라 다릅니다.
- 산을 분리하여 이온으로 뿌려진다. 소금은 산으로부터 음이온과 함께 염기의 양이온이다. 다른 제품은 물입니다.
예를 들어, 염산 (HCL)과 수산화 알루미늄 [Al (OH) 3 사이의 반응 생성물을 식별합니다. ] 그리고 최종 pH가 산성, 중성 또는 알칼리인지 여부.
당신은 차트 나 다른 암기에서 염산이 강산이고 수산화 알루미늄은 강한 염기가 아니기 때문에 약한 염기 여야한다는 것을 알고 있습니다. 강산과 약한 염기 사이의 반응의 pH는 7 미만이므로 pH는 산성입니다.
염산은 H 및 Cl로 분리되는 반면, 수산화 알루미늄은 Al 및 3 OH로 분리됩니다. 염은 염기 (Al)의 양이온을 산 (Cl)의 음이온과 결합하여 Alcl 3 를 형성합니다. .
균형 균형 산의 두더지 수 (h)가 염기의 두더지 수와 같습니다 (OH) :
3HCL + al (OH) 3 → alcl 3 + h 2 o
일상 생활에서 중화 반응의 예
중화 반응은 일상 생활에서 일반적입니다.
- 항산제 테이블은 위의 과도한 위산 (HCL)을 중화시키는 약한 염기 (예 :중탄산 나트륨)를 함유하고 있습니다.
- 인간 소화 시스템은 또한 위산을 중화시킨다. 췌장은 내장에서 영양소 흡수를 허용하는 중탄산염 제산제를 생산합니다.
- 중탄산 나트륨과 같은 약한베이스는 산 유출과 화상을 안전하게 중화시킵니다.
- 치약에는 입에서 박테리아에 의해 방출 된 산을 중화시키는 약한베이스가 포함되어 있습니다.
- 수산화 칼슘 또는 석회암 (탄산 칼슘)은 pH를 높이고 식물 성장을 돕는 토양 처리입니다.
- 비료 생산은 질산 또는 황산을 암모니아로 중화시켜 질산 암모늄 또는 황산 암모늄을 형성하는 것을 포함합니다.
- 스크러버는 석탄 연소에서 형성된 산을 중화시킨다.
- 적정은 알려지지 않은 용액의 농도를 식별하는 중화 반응입니다.
참조
- Trummal, Aleksander; 리핑, 로리; Kaljurand, Ivari; Koppel, Ilmar A.; Leito, Ivo (2016). “물과 디메틸 설폭 사이드의 강산 산도”. 물리 화학 저널 A . 120 (20) :3663–3669. doi :10.1021/acs.jpca.6b02253
- Skoog, D.A; West, D.M.; Holler, J.F.; 크라우치, S.R. (2004). 분석 화학의 기초 (8th ed.). Thomson Brooks/Cole. ISBN 0-03-035523-0.
- snoeyink, v.l.; Jenkins, D. (1980). 수생 화학 :화학 평형 및 자연수의 속도 . 뉴욕 :와일리. ISBN 0-471-51185-4.
- Zumdahl, Steven S. (2009). 화학 원리 (6th ed.). 뉴욕 :Houghton Mifflin Company.