핵심 개념
이 튜토리얼에서는 분자의 분자 형상 및 결합 각도를 식별하는 방법을 배웁니다. 더 일반적인 분자 형상에 대해 배우게됩니다 :사면체, 선형, 구부러진, 삼각 피라미드 및 삼각 평면 - 결합 각도
.이 튜토리얼을 즐기면 아래에 나열된 Bonding에 대한 다른 자습서를 자유롭게 확인하십시오.
다른 기사에서 다루었습니다
- 분자 결합
- 루이스 구조
어휘
- 전자 형상 :중앙 원자 주위의 결합 및 고독한 쌍의 배열을 설명합니다.
- 분자 형상 :전자 만 결합에 대한 승인으로 중앙 원자 주변의 원자의 배열을 설명합니다.
- 하이브리드 화 :전자를 뿌리기 위해 궤도가 결합됩니다.
- 결합 각도 :원자의 인접한 결합 사이의 각도.
분자 기하학이란 무엇입니까?
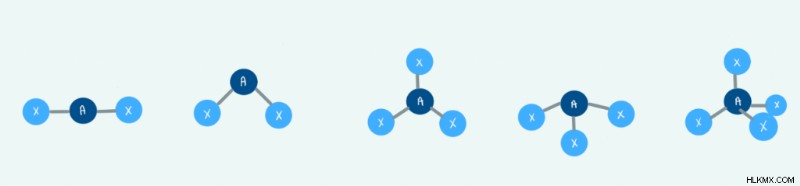
분자 형상은 분자의 3 차원 구조를 설명합니다. 화학자들은 원자가 껍질 전자-쌍 반발 이론 또는 VSEPR을 사용하여 원자 및 화학 결합의 배열을 예측할 수 있습니다. 이 이론은 전자가 서로를 격퇴하고 그에 따라 결합 될 것이라는 생각을 중심으로 진행됩니다.
구성 및 각도 유형
구성에는 세 가지 주요 유형이 있습니다 :선형, 삼각형 및 사면체. 아래는 채권 파트너 수와 이러한 구성 사이의 관계를 보여주는 테이블입니다.
| 구성 | 본딩 부착물 | 본드 각도 | ||
| 선형 | 2 | 180 | ||
| trigonal | 3 | 120 | ||
| 사면체 | 4 | 109.5 |
| 첨부 파일 | 분자 형상 | 전자 형상 | 하이브리드 화 | 본드 각도 |
| 2 | 선형 | 선형 | sp | 180 |
| 3 | Trigonal 평면 | Trigonal 평면 | sp | 120 |
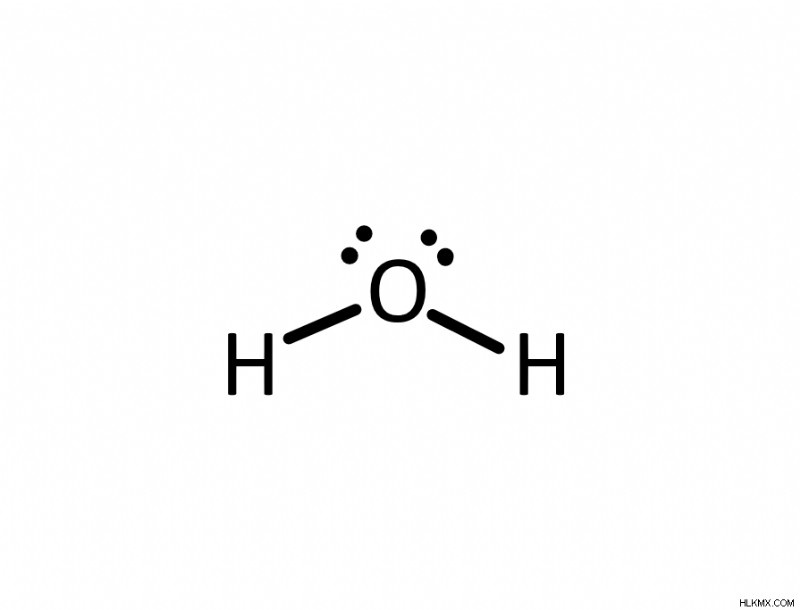
| 3 (2 개의 본드와 1 개의 고독 쌍) | 구부러진 | Trigonal 평면 | sp | 약 118 |
| 4 | 사면체 | 사면체 | sp | 109.5 |
| 4 (3 개의 본드와 1 개의 고독 쌍) | Trigonal Pyramidal | 사면체 | sp | <109.5 |
| 4 (2 개의 결합 및 2 개의 고독 쌍) | 구부러진 | 사면체 | sp | 약 105 |