네온은 주기율표의 10 번째 요소입니다. 이러한 네온 사실에는 일반 정보 및 역사와 함께 화학 및 물리적 데이터가 포함됩니다.

기본 네온 사실
이름 : 네온
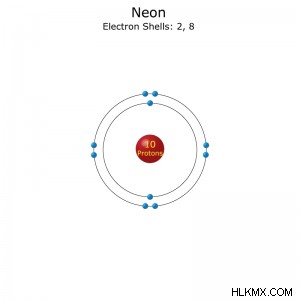
원자 번호 : 10
요소 기호 : ne
그룹 : 18
기간 : 2
블록 : p
요소 가족 : 고귀한 가스
원자 질량 : 20.1797 (6)
전자 구성 : [그는] 2S2P (속도) 또는 1S2S2P (Full)
발견 : 1898 년 William Ramsay 경과 Morris W. Travers.
램지는 이미 아르곤과 헬륨을 발견했다. 그는주기적인 테이블에 둘 사이에 나타날 요소가 있어야한다고 추론했다. 그들은 결국 가스를 액체 공기에서 감압하에 분리시켰다. 그들은 스펙트럼을 얻기 위해 샘플을 이온화했습니다. 한 샘플은 전에는 보지 못했던 생생한 빨간색 빛으로 빛납니다. 그들은 즉시 네온 요소를 발견했다는 것을 알았습니다.
이름 원산지 : Ramsay는 그리스어 neos의 요소 네온을 지명했습니다. 새로운 의미.
동위 원소 :
천연 네온은 NE, NE 및 NE의 세 가지 안정적인 동위 원소로 구성됩니다. 16 개의 방사성 동위 원소는 NE에서 NE까지의 실험실 조건에서 생성되었습니다.
NE
Neon-20은 10 개의 중성자를 함유하는 안정적인 동위 원소입니다. 천연 네온의 90.48%는 네온 -20입니다.
NE
Neon-21은 11 개의 중성자를 함유하는 안정적인 동위 원소입니다. 천연 네온의 0.27%는 네온 -21입니다.
NE
Neon-22는 12 개의 중성자를 함유하는 안정적인 동위 원소입니다. 천연 네온의 9.25%는 네온 -22입니다.

물리적 데이터
밀도 : 0.000825 g/cm
용융점 : 24.56 K (-248.59 ° C, -415.46 ° F
끓는점 : 27.104 K (-246.046 ° C, -410.883 ° F)
트리플 포인트 : 43.37 kPa에서 24.5561 K
임계점 : 44.4918 K, 2.7686 MPA
20ºC의 상태 : 가스
융합의 열 : 0.335 kj/mol
기화의 열 : 1.71 kj/mol
어금니 열 용량 : 20.79 J/mol · K
원자 데이터
원자 반경 : 1.54 Å
공유 반경 : 0.58 Å
van der waals 반경 : 1.54 Å
전자 친화력 : 안정적이지 않음
전기 음성 : 미지의
1 이온화 에너지 : 2080.662 kj/mol
2 이온화 에너지 : 3952.325 kj/mol
3 이온화 에너지 : 6121.99 kj/mol
4 이온화 에너지 : 9370.66 kj/mol
5 이온화 에너지 : 12177.41 kj/mol
6 이온화 에너지 : 15237.93 kj/mol
7 이온화 에너지 : 19999.086 KJ/mol
8 이온화 에너지 : 23069.539 kj/mol
산화 상태 : 0

재미있는 네온 사실
- 네온은 실온에서 무색, 무취 및 맛이없는 가스입니다.
- 네온은 우주에서 네 번째로 가장 풍부한 요소이지만 지구에서는 비교적 드물다. 공기 55,000 부분 중 하나만 네온입니다.
- 네온은 자연스럽게 다른 요소와 결합하지 않습니다. 알려진 헬륨 화합물이 없습니다.
- 유명한 네온 사인은 1910 년 Georges Claude에 의해 발명되었습니다. 그들은 파리 엑스포에서 데뷔했다.
- 네온은 공기 중의 질소와 산소의 규정형 요소보다 가볍습니다. 네온 가스로 풍선을 채우면 헬륨 채워진 풍선처럼 떠 다니지 만 느리게 상승합니다.
- 네온은 전력선과 전신의 번개에 사용됩니다.
- 네온의 유일한 상업 공급원은 공기입니다.
- 액체 네온은 냉매로 사용됩니다. 액체 헬륨의 부피당 냉각 용량의 40 배, 액체 수소로 3 배 이상.
주기율표에서 요소에 대해 자세히 알아보십시오.