pH 지표 또는 산-염기 지표는 pH에 따라 색상 변화를 일으키는 용액에 소량으로 첨가 된 화학 물질이다. 이것은 공통 지표에 대한 책임, 그들이 어떻게 작동하는지에 대한 설명, 그리고 당신의 요구에 맞는 올바른 것을 선택하기위한 팁입니다.
pH 표시기 사용 방법
지표는 정확한 pH 또는 수소 이온 농도에서 색을 바꾸지 않습니다. 대신, 색상 변화는 다양한 수소 이온 농도에 걸쳐 발생합니다. 약간 알칼리성 조건 하에서 변화하는 지표를 사용하여 약산을 적정합니다. 약간 산성적인 pH에서 색상을 변화시키는 지표를 사용하여 약한 염기를 적정합니다. 강산 또는 염기를 적정 할 때, 중성 pH 근처에 색 변화를 나타내는 pH 지표를 목표로합니다.
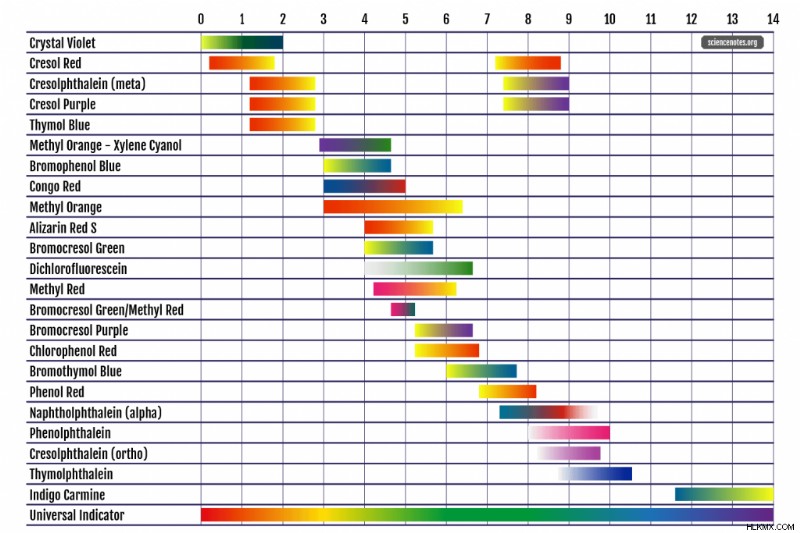
공통 pH 지표 차트
다음은 일반적인 pH 지표, pH 범위, 솔루션 및 색상 변화의 차트입니다. 일부 표시기는 여러 색상 변경을 표시하므로 목록에서 두 번 이상 발생합니다. 다양한 참조는 약간 다른 pH 값과 색상을 나열합니다. pH 범위가 잘 정의되지 않았기 때문에 (1 pH 값 내에서 정확도를 기대) 색상은 판단 호출입니다.
| 표시기 | pH 범위 | 10 ml 당 수량 | 산 | 베이스 |
| Thymol Blue | 1.2-2.8 | 1-2 방울 0.1% soln. aq. | 에서빨간색 | 옐로우 |
| Pentamethoxy Red | 1.2-2.3 | 1 드롭 0.1% soln. 70% ALC에서 | 빨간색 | 무색 |
| Tropeolin oo | 1.3-3.2 | 1 드롭 1% aq. Soln. | 빨간색 | 옐로우 |
| 2,4- 디 니트로 페놀 | 2.4-4.0 | 1-2 방울 0.1% soln. 50% Alc. | 무색 | 옐로우 |
| 메틸 옐로우 | 2.9-4.0 | 1 드롭 0.1% soln. 90% ALC에서 | 빨간색 | 옐로우 |
| 메틸 오렌지 | 3.1-4.4 | 1 드롭 0.1% aq. Soln. | 빨간색 | 오렌지 |
| Bromophenol Blue | 3.0-4.6 | 1 드롭 0.1% aq. Soln. | 옐로우 | 블루-예산 |
| Tetrabromophenol Blue | 3.0-4.6 | 1 드롭 0.1% aq. Soln. | 옐로우 | 블루 |
| 알리자린 나트륨 설포 네이트 | 3.7-5.2 | 1 드롭 0.1% aq. Soln. | 옐로우 | 바이올렛 |
| α-Naphthyl Red | 3.7-5.0 | 1 드롭 0.1% soln. 70% ALC에서 | 빨간색 | 옐로우 |
| p -에 톡시 크라이 소디 딘 | 3.5-5.5 | 1 드롭 0.1% aq. Soln. | 빨간색 | 옐로우 |
| Bromocresol Green | 4.0-5.6 | 1 드롭 0.1% aq. Soln. | 옐로우 | 블루 |
| 메틸 레드 | 4.4-6.2 | 1 드롭 0.1% aq. Soln. | 빨간색 | 옐로우 |
| Bromocresol Purple | 5.2-6.8 | 1 드롭 0.1% aq. Soln. | 옐로우 | 보라색 |
| 클로로 페놀 레드 | 5.4-6.8 | 1 드롭 0.1% aq. Soln. | 옐로우 | 빨간색 |
| Bromophenol Blue | 6.2-7.6 | 1 드롭 0.1% aq. Soln. | 옐로우 | 블루 |
| p -니트로 페놀 | 5.0-7.0 | 1-5 방울 0.1% aq. Soln. | 무색 | 옐로우 |
| azolitmin | 5.0-8.0 | 5는 0.5% aq. Soln. | 빨간색 | 블루 |
| 페놀 레드 | 6.4-8.0 | 1 드롭 0.1% aq. Soln. | 옐로우 | 빨간색 |
| 중성 빨간색 | 6.8-8.0 | 1 드롭 0.1% soln. 70% ALC에서 | 빨간색 | 옐로우 |
| Rosolic Acid | 6.8-8.0 | 1 드롭 0.1% soln. 90% ALC에서 | 옐로우 | 빨간색 |
| 크레졸 레드 | 7.2-8.8 | 1 드롭 0.1% aq. Soln. | 옐로우 | 빨간색 |
| α-Naphtholphthalein | 7.3-8.7 | 1-5 방울 0.1% soln. 70% ALC에서 | 로즈 | 녹색 |
| Tropeolin ooo | 7.6-8.9 | 1 드롭 0.1% aq. Soln. | 옐로우 | Rose-Red |
| Thymol Blue | 8.0-9.6 | 1-5 방울 0.1% aq. Soln. | 옐로우 | 블루 |
| Phenolphthalein | 8.0-10.0 | 1-5 방울 0.1% soln. 70% ALC에서 | 무색 | 빨간색 |
| α-Naphtholbenzein | 9.0-11.0 | 1-5 방울 0.1% soln. 90% ALC에서 | 옐로우 | 블루 |
| Thymolphthalein | 9.4-10.6 | 1 드롭 0.1% soln. 90% ALC에서 | 무색 | 블루 |
| 나일 블루 | 10.1-11.1 | 1 드롭 0.1% aq. Soln. | 블루 | 빨간색 |
| 알리자린 옐로우 | 10.0-12.0 | 1 드롭 0.1% aq. Soln. | 옐로우 | lilac |
| 살리실 옐로우 | 10.0-12.0 | 1-5 방울 0.1% soln. 90% ALC에서 | 옐로우 | 오렌지-브라운 |
| Diazo Violet | 10.1-12.0 | 1 드롭 0.1% aq. Soln. | 옐로우 | 바이올렛 |
| Tropeolin o | 11.0-13.0 | 1 드롭 0.1% aq. Soln. | 옐로우 | 오렌지-브라운 |
| 니트 라민 | 11.0-13.0 | 1-2는 70% ALC에서 0.1% soln을 떨어 뜨립니다. | 무색 | 오렌지-브라운 |
| Poirrier 's Blue | 11.0-13.0 | 1 드롭 0.1% aq. Soln. | 블루 | 바이올렛 핑크 |
| 트리 니트로 벤조산 | 12.0-13.4 | 1 드롭 0.1% aq. Soln. | 무색 | 오렌지-레드 |
| PH 범위 | 색상 | 을 나타냅니다 |
| <3 | 빨간색 | 강한 산성 |
| 3 ~ 6 | 오렌지에서 노란색 | 약한 산성 |
| 7 | 녹색 | 중립 |
| 8 ~ 11 | 블루 | 약한 알칼리성 (기본) |
| > 11 | indigo to Violet | 강하게 알칼리성 (기본) |