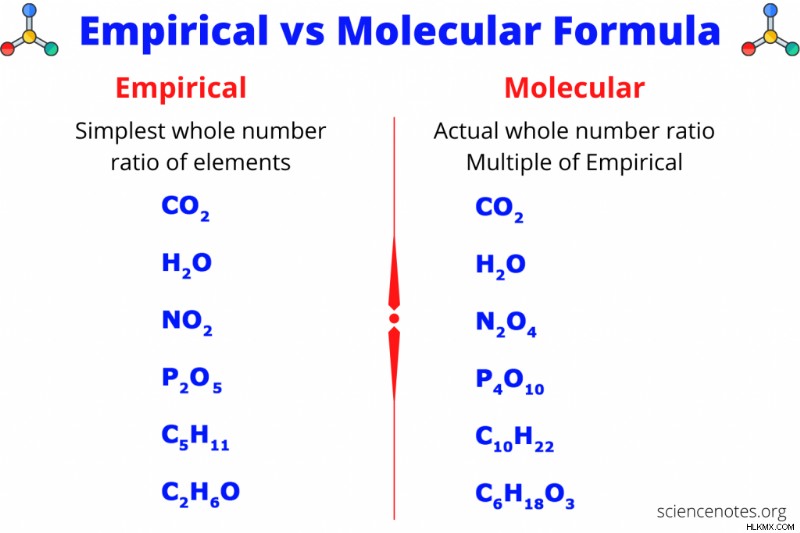
경험적 및 분자 공식은 화합물의 요소의 비율 또는 비율을 알려주는 두 가지 유형의 화학적 공식입니다. 경험적이거나 가장 간단한 공식은 화합물에서 요소의 가장 작은 정수 비율을 제공하는 반면, 분자 공식은 요소의 실제 정수 비율을 제공합니다. 분자 공식은 경험적 공식의 배수이지만 때로는 경험적 공식에 "1"을 곱하므로 두 공식은 동일합니다. 연소 및 구성 분석은 항상 경험적 공식을 제공하지만 분자량을 알고 있다면 분자 공식을 찾을 수 있습니다. 다음은 경험적 및 분자 공식의 예와 질량 백분율 및 분자량에서 이러한 공식을 찾는 방법을 보여주는 문제 문제입니다.
경험적 공식
경험적 공식은 화합물의 가장 간단한 공식입니다. 공식의 모든 위자를 가장 낮은 공통 분모로 나누어 분자 공식에서 경험적 공식을 얻을 수 있습니다. 예를 들어, 분자 공식이 H 2 인 경우 o 2 , 가장 낮은 공통 분모는 2입니다. 두 첨자를 2로 나누면 가장 간단한 HO 공식을 제공합니다. 분자 공식이 C 6 인 경우 H 12 o 6 , 가장 낮은 공통 분모는 6이고 가장 간단한 공식은 ch 2 입니다. O. 분자식이 Co 2 인 경우 , 가장 낮은 공통 분모는 1이고 경험적 공식은 분자식과 동일합니다.
분자식
분자식은 화합물의 실제 공식입니다. 경험적 공식과 마찬가지로, 위시는 항상 양수 정수입니다. 분자식은 경험적 공식의 다중입니다. 예를 들어, 헥산의 경험적 공식은 c 3 입니다 H 7 , 분자 공식은 C 6 입니다 h 14 . 경험적 공식의 두 첨자는 분자 공식을 얻기 위해 2를 곱했습니다.
경험적 대 분자식
다음은 경험적 대 분자 공식의 간단한 비교입니다.
| 경험적 공식 | 분자식 |
| 화합물의 가장 단순한 원소 조성 | 화합물의 실제 원소 조성 |
| 화합물에서 원소의 질량 백분율에서 발견되었습니다 | 는 화합물의 경험적 공식과 분자량을 사용하여 발견되었습니다 |
| 요소의 간단한 정수 비율 | 정수 비율로 남아있는 경험적 공식의 배수 |
| 연소 또는 구성 분석에서 발견되었습니다 | 는 화학 반응을 작성하고 구조적 공식을 그려야합니다 |
경험적 공식에서 분자식을 찾는 단계
경험적 공식과 분자량에서 분자식을 찾을 수 있습니다.
예
예를 들어, 경험적 공식이 C 3 라는 것을 알고 헥산의 분자식을 찾아 봅시다. H 7 분자량은 86.2 amu.
입니다
먼저 분자의 공식 중량을 계산하십시오. 이렇게하려면 각 요소의 원자량을 찾아보고 경험적 공식의 첨자로 각각을 곱한 다음 모든 값을 추가하여 공식 가중치를 얻습니다.
.
탄소 :12.01 x 3 =36.03
수소 :1.008 x 7 =7.056
공식 무게 =36.03 + 7.056 =43.09 amu
이제 분자식이 경험적 공식의 배수 여야한다는 것을 알고 있습니다. 분자량을 경험적 중량으로 나누어 분자량과 공식 중량 사이의 비율을 찾으십시오 :
분자량 / 경험적 중량 =86.2 / 43.09 =2
종종 소수점 값을 얻을 수 있지만 정수에 가까워 야합니다. 마지막으로, 분자식을 얻으려면이 정수에 의해 경험적 공식에 각 첨자를 곱하십시오.
c 3 × 2 h 7 × 2 =c 6 h 14
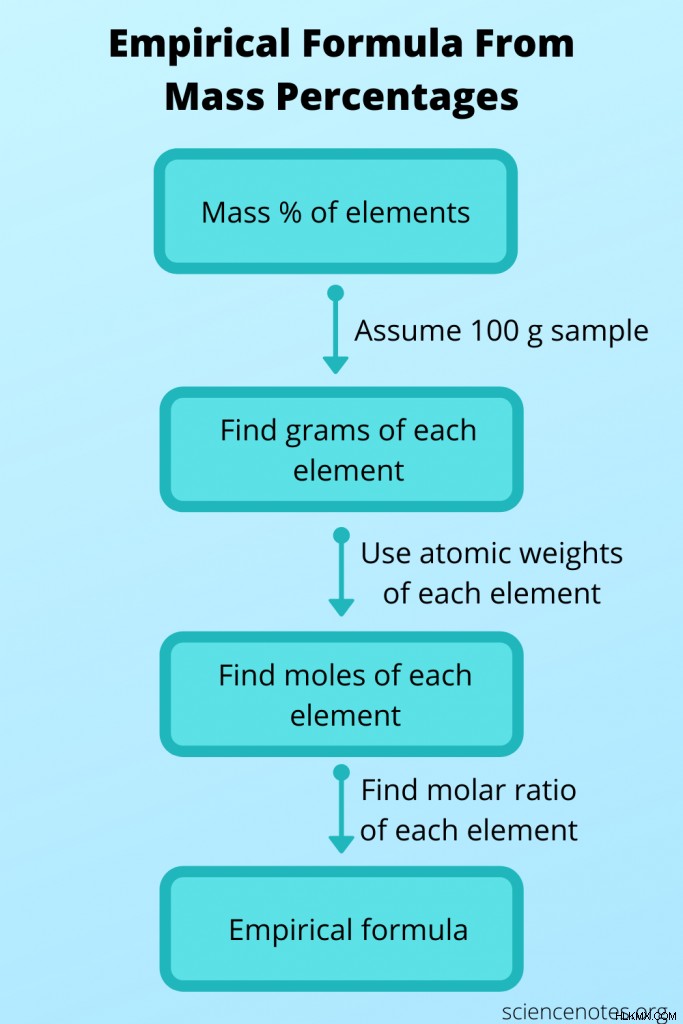
때로는 경험적 공식을 알지 못하지만 다른 데이터에서 결정한 다음 분자 공식을 얻는 데 사용할 수 있습니다. 이 경우, 분자량으로부터 화합물의 분자 공식과 각 원자의 질량 백분율을 찾으십시오. 이렇게하려면 다음 단계를 따르십시오.
- 화합물의 100 그램 샘플이 있다고 가정합니다. 이런 식으로 질량 퍼센트 값은 모두 깔끔하게 추가하여 각 요소의 그램 수를 제공합니다.
- 주기적인 테이블을 사용하여 각 요소의 원자량을 찾으십시오. 원자 무게는 요소의 한 두더지 당 그램의 수입니다. 이제 각 요소의 그램 수를 몰수 수로 변환 할 수 있습니다.
- 각 두더지 값을 가장 적은 수의 두더지로 나누어 요소 사이의 두더지 비율을 찾으십시오. 이 비율을 사용하여 경험적 공식을 얻으십시오.
- 경험적 공식을 사용하여 화합물의 공식 중량을 계산합니다. 이렇게하려면 원자량을 각 요소의 첨자로 곱한 다음 모든 값을 추가하십시오.
- 분자량을 공식 중량으로 나누어 분자식과 경험적 공식 사이의 비율을 찾으십시오. 이 숫자를 반올림하여 정수입니다.
- 분자 공식을 작성하기 위해 정수에 의해 경험적 공식의 모든 위시를 곱합니다.
예
예를 들어, 분자 질량이 176 amu이고 샘플이 질량에 따라 40.92% C, 4.58% H 및 54.50% O 인 경우, 아스코르브 산 (비타민 C)의 경험적 공식과 분자 공식을 찾으십시오.
.
먼저 100 그램 샘플이 있다고 가정하여 각 요소의 질량을 만듭니다.
- 40.92 G C
- 4.58 G H
- 54.50 g o
다음으로, 이들 요소의 원자량을 찾아 각 요소의 분자가 얼마나 많은지 알아보십시오. 이 단계에 대해 불확실한 경우 그램에서 두더지 전환을 수행하는 방법을 검토하십시오.
- mol c =40.92 g x (1 mol/12.011 g) =3.407 mol c
- mol H =4.58 g x (1 mol/1.008 g) =4.544 mol H
- mol O =54.50 g x (1 mol/15.999 g) =3.406 mol o
각 두더지 값을 가장 작은 값으로 나누어 요소들 사이에서 가장 간단한 정수 비율을 찾으십시오 (이 예에서 3.406). 정수 값을 얻는 데 사용할 수있는 분수를 나타 내기 때문에 "1.5", "1.333"또는 "1.667"과 같은 소수점 값을 확인하십시오.
. - c =3.407 mol / 3.406 mol =1.0
- h =4.544 mol / 3.406 mol =1.334
- o =3.406 mol / 3.406 mol =1.0
경험적 공식의 첨자는 정수가되어야하지만 수소는 분수입니다. 전체 번호를 얻으려면 어떤 번호를 곱 해야하는지 스스로에게 물어봐야합니다. ".33"은 1/3의 소수점 값이므로 모든 숫자를 3을 곱하여 정수를 얻을 수 있습니다.
- c =1.0 x 3 =3
- h =1.333 x 3 =4
- o =1.0 x 3 =3
이 값을 첨자로 연결하면 경험적 공식을 얻을 수 있습니다.
c 3 H 4 o 3
분자 공식을 찾으려면 먼저 각 첨자에 원자의 원자량을 곱하여 모든 값을 추가하여 경험적 공식 질량을 결정하고 모든 값을 추가합니다.
(3 x 12.011) + (4 x 1.008) + (3 x 15.999) =88.062 amu
이 값이 샘플의 분자량과 거의 동일하다면 분자식은 경험적 공식과 동일합니다. 88.062는 176과 다르기 때문에 분자식이 경험적 공식의 다중라는 것을 알고 있습니다. 분자량을 경험적 공식 중량으로 나누어 승수를 찾으십시오 :
.
176 AMU / 88.062 AMU =2.0
마지막으로, 분자 공식을 얻기 위해 경험적 공식의 각 첨자를이 숫자로 곱하십시오 :
아스코르브 산의 분자식 =C <서브> 3 × 2 H 4 × 2 o 3 × 2 =c 6 H 8 o 6
구조 공식
경험적 및 분자 공식은 화합물의 원자의 유형과 수를 나타냅니다. 그러나 그 원자가 어떻게 배열되는지는 알려주지 않습니다. 구조적 공식은 단일, 이중 및 삼중 결합, 고리 및 때로는 3 차원 입체 형태를 나타냅니다. 구조적 공식의 유형은 루이스 구조, 골격 공식, 뉴먼 투영, 톱마스 투영, Haworth Projection 및 Fischer 예측이 포함됩니다.
참조
- 버로우, 앤드류. (2013). 화학 :무기, 유기 및 물리 화학 도입 (제 2 판). 옥스퍼드. ISBN 978-0-19-969185-2.
- Petrucci, Ralph H.; Harwood, William S.; 청어, F. Geoffrey (2002). 일반 화학 :원리 및 현대 응용 (8th ed.). 상단 새들 강, 뉴저지 :프렌 티스 홀. ISBN 978-0-13-014329-7.