핵심 개념
이 튜토리얼에서는 이온 반경 트렌드를 소개합니다 주기적인 요소 테이블에서. 또한 찾는 방법을 포함하여 이온 반경에 기여하는 개념을 소개합니다.
다른 기사에서 다루는 주제
- 주기율표 금속 및 비 메탈
- 원자 반경 동향
- 전자 구성 작성 방법
- 원자가 전자
- 격자 에너지 가란?
어휘
- 원자 반경 - 화학 요소의 원자 반경은 원자의 크기, 일반적으로 핵의 중심에서 가장 외부 분리 된 전자까지 평균 또는 전형적인 거리의 척도입니다.
- 이온 반경 - 이온 성 결정 구조에서 모나토미 이온의 반경입니다. 원자 나 이온은 날카로운 경계를 가지고 있지 않지만, 양이온과 음이온의 이온 반경의 합이 결정 격자에서 이온 사이의 거리를 제공하도록 반경을 가진 단단한 구체 인 것처럼 취급된다. .
- 원자가 전자 - 원자의 가장 바깥 쪽 쉘 또는 에너지 레벨의 전자.
이온이란 무엇입니까?
이온은 양전하 또는 음수를 전달하는 원자입니다. 주기성 테이블의 원자가 전자를 잃으면 양이온이됩니다. 대조적으로,주기 테이블의 원자가 전자를 얻을 때 음이온이됩니다.
주기율표의 대부분의 금속은 양이온을 형성하는 경향이 있습니다. 예를 들어, 그룹 1A (알칼리 금속)의 금속은 모두 +1 전하를 가지며, 즉 전자를 제공하고자합니다. 비 메탈은 음이온이되는 경향이 있습니다.
이온 반경
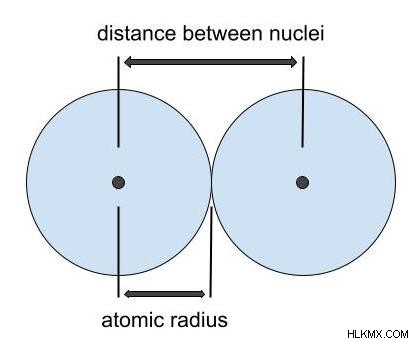
정의에 따르면, 이온 반경은 이온의 핵에서 전자의 가장 바깥 쪽 쉘 (원자가 쉘)의 거리입니다. 따라서 아래 그림에서 이온 반경은 핵의 노란색과 파란색 양성자 사이의 거리를 측정하여 발견됩니다. 가장 바깥 쪽 궤도의 붉은 전자에. 이것은 반경을 측정 할 수있는 방법에 대한 좋은 시각화이지만, 궤도의 경계가 매우 흐릿하기 때문에 정확하지 않을 것입니다.
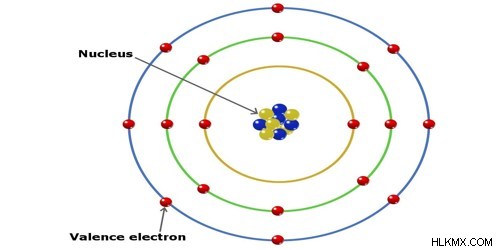
원자가 결정 격자 구조에있을 때 이온의 이온 반경은 측정된다. 이온 반경은 서로 닿는 두 이온 사이의 거리의 절반입니다. 위에서 언급했듯이 전자 쉘의 쉘 경계는 읽기 어렵다. 따라서 원자의 이온은 마치 구인 것처럼 취급됩니다. 이온 반경은 원자 반경보다 약간 작거나 클 수 있습니다.
이온 반경 찾기
이온은 결합에 존재하는 경향이 있기 때문에, 이온 반경은 두 원자 사이의 이온 결합을 통해 발견 될 수있다. 더욱이, 이온 반경은 이온이 위치한 환경의 다양한 요인에 의존하기 때문에 측정하기가 까다 롭습니다. 그것은 중앙 원자 또는 이온이 복합체 또는 조정 화합물에서 가장 가까운 이웃으로 보유하는 원자, 이온 또는 분자의 수에 따라 다릅니다. 또한 이온의 스핀 상태에 따라 다릅니다. 이온 반경은 일반적으로 두 핵 사이의 거리를 추정하고 원자 크기에 따라 나누어 계산됩니다. 이온 반경은 일반적으로 Piceter (PM) 또는 나노 미터 (NM)에서 측정됩니다.
양이온 대. 음이온
양이온은 원자가 껍질에서 전자를 잃기 때문에 종종 부모 중성 원자보다 작은 이온 반경을 가지고 있습니다. 음이온의 경우 음이온은 전자를 가장 바깥 쪽 껍질로 얻기 때문에 일반적으로 부모 중성 원자보다 반경이 더 큰 전자를 얻습니다.
.ex . 나트륨 (NA)의 원자 반경은 190 PM이지만 나트륨 (NA)의 이온 반경은 오후 116시입니다.
ex . 염소 원자 (CL)의 원자 반경은 오후 79시이고 염소 이온 (CL)의 이온 반경은 167 pm입니다.
주기율표에서 이온 반경 경향
이온 반경 및 그룹
주기적 테이블을 아래로 이동하면 추가 전자가 추가되어 이온 반경이 증가합니다.
주기율표 (알칼리성 지구 금속)의 그룹 2를보십시오
- 베릴륨 이온 반경 - 오후 31시
- 마그네슘 이온 반경 - 오후 65시
- 칼슘 이온 반경 - 오후 99시
- Strontium 이온 반경 - 113 PM
- 바륨 이온 반경 - 135 PM
주기적 테이블을 아래로 이동할 때 원자 반경 증가 추세와 일치합니다.
이온 반경 및 기간
주기율표를 가로 질러 이동하면 더 많은 전자, 양성자 및 중성자가 추가됩니다. 따라서 반경이 증가하는 것은 의미가 있지만 그렇지 않습니다. 주기성 테이블의 행 위로 이동함에 따라 이온 반경이 양이온을 형성하는 금속의 경우 감소하기 때문입니다. 효과적인 핵 전하가 감소함에 따라 비금속의 이온 반경이 증가합니다.
칼륨 (k)에서주기적인 테이블을 가로 질러 움직입니다
- 칼륨 (k) 이온 반경 - 137 PM
- 칼슘 이온 성 (CA) 반경 - 오후 99시
- Scandium Ionic (SC) 반경 - 87 PM
주기율표에서 오른쪽으로 이동하면 이온 반경 크기가 감소합니다.