화학에서 양서류 물질은 반응 조건에 따라 산과 염기로 작용할 수있는 화학 종입니다. 이 현상은 양서류 이라고합니다 .
양서류는 청동 고장과 루이스 산 및베이스에 적용됩니다. 이 단어는 그리스어 단어 amphoteros 에서 나온 것입니다 또는 AmphoTeroi , 이는“각각 또는 둘 다”를 의미하며 물질이“산성 또는 알칼리성”이라는 것을 의미합니다.
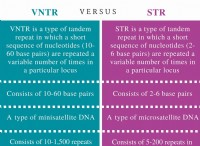
양서류 물질
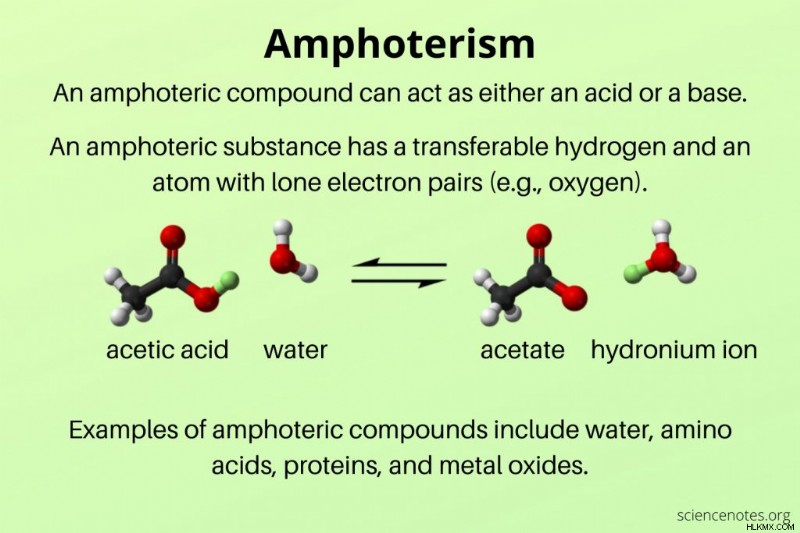
양서류 물질은 전달 가능한 수소 (양성자) 및 고독한 전자 쌍을 갖는 원자를 갖는다. 양서류 물질의 예로는 물, 아미노산, 단백질 및 많은 금속 산화물 및 수산화물이 있습니다.
알루미늄, 안티몬, 비소의 산화물 및 수산화물, 안티몬, 비스무트, 베릴륨, 크롬, 코발트, 구리, 갈륨, 게르마늄, 금, 철,은,은, 텔 루륨, 주석 및 아연은 양서류입니다. 그러나, 알칼리 금속 및 알칼리성 지구의 산화물은 기본적인 산화물을 형성하며 양서류가 아니다. 가장 수륙 양용 금속 산화물과 수산화물은 주기율표의 중심 근처에서 발견되는 금속에서 나옵니다.
일부 물질은 일반적으로 산 또는 염기로 간주됩니다. 실제로는 수륙 양용입니다. 예를 들어, 황산 (H 2 그래서
양서류의 예
예를 들어, 물의 양서류를 고려하십시오 (h 2 o) :
물은 염산 (HCL)과 같은 산과 반응 할 때 양성자를 수용합니다.
H 2 O + HCl ⇌ H 3 o + cl
물은 암모니아 (nh 3 와 같은 염기와 반응 할 때 양성자를 기증합니다. ).
H 2 o + nh 3 nh 4 + 오
유사하게, 산화 알루미늄과 같은 양서류 금속 산화물 (Al 2 o 3 )은 산과 반응 할 때 및 염기와 반응 할 때 산으로서베이스로 작용한다.
al 2 o 3 (s) + 6H 3 0 (aq) + 3H 2 o (l) → 2 [al (Oh 2 )
al 2 o 3 (s) + 2oh (aq) + 3H 2 o (l) → 2 [al (OH)
양서류 물질을 식별하는 방법
수륙 양용 물질을 식별하려면 다른 분자에서 수소 이온을 첨가하고 제거 할 수있는 능력을 찾으십시오. 양서류 물질은 동일한 분자의 산성 및 기본 성분 둘 다 또는 양이온 또는 음이온의 다중 전하를 함유 할 수 있습니다.
가 아닌 종을 보는 데 도움이 될 수 있습니다. 수륙 양용. 예를 들어, 아산 (HNO 2 )는 산이며, 기본 역할을 할 수 없기 때문에 양서류가 아닙니다. 그것은 수소 양이온을 방출하기 위해 분리되고 no
hno 2 → h + no 2 - -
관련 용어
양서류 :양서류 종은 조건에 따라 양성자 (h)를 받아들이거나 기증하는 양쪽 복식 물질의 한 유형입니다. 산과 염기의 루이스 이론 하에서, 양서류 종은 수륙 양용이지만, 모든 수륙 양용 물질이 양서류는 아니다. 산과 염기의 청동 끈이 많은 이론에서, 수륙 양용 및 양서류는 같은 것을 의미합니다.
양서류 :양친 매성은 산성 및 염기성 그룹을 모두 함유하는 수륙 양용 화합물이다. 예를 들어, 아미노산은 수소를 기증 할 수있는 아미노 그룹과 카르 복실 그룹이 수소를 받아 들일 수있는 카르 복실 그룹을 가지고 있습니다.
참조
- Housecroft, C. E.; Sharpe, A. G. (2004). 무기 화학 (제 2 판). 프렌 티스 홀. ISBN 978-0-13-039913-7.
- iupac (1997). "양서류". 화학 용어의 개요 (2 판) (“골드 북”). 블랙웰 과학 간행물. ISBN 0-9678550-9-8. doi :10.1351/goldbook.a00306
- Petrucci, Ralph H.; Harwood, William S.; 청어, F. Geoffrey (2002). 일반 화학 :원리 및 현대 응용 (8th ed.). 상단 새들 강, 뉴저지 :프렌 티스 홀. ISBN 978-0-13-014329-7.
- Skoog, Douglas A.; 웨스트, 도널드 M.; Holler, F. James; Crouch, Stanley R. (2014). 분석 화학의 기초 (9th ed.). 벨몬트, 캘리포니아 ISBN 978-0-495-55828-6.