주요 차이 - 4F vs 5F 궤도
원자는 전자로 둘러싸인 양성자와 중성자로 만들어진 핵으로 구성됩니다. 이 전자는 핵 주위에서 연속적인 움직임에 있습니다. 따라서, 우리는 원자에서 전자의 특정 위치를 줄 수 없습니다. 과학자들은 전자의 정확한 위치를 찾는 대신“확률”이라는 개념을 도입했습니다. 다시 말해, 전자가 움직일 가능성이 가장 높은 가장 가능성이 높은 경로가 결정됩니다. 이 경로를 궤도라고합니다. S 궤도, P 궤도, D 궤도 및 F 궤도와 같은 궤도의 다른 서브 세트가 있습니다. 각 서브 세트에서 궤도의 수는 자기 양자 수에 의해 결정된다. F 궤도의 경우 7 개의 가능한 자기 양자 수가 있으므로 7 개의 F 궤도가 있습니다. 4F 및 5 F 궤도는 F 궤도에서 첫 번째 세트 및 두 번째 세트입니다. 4F와 5F 궤도의 주요 차이점은 4F 궤도에 다수의 평면과 원뿔형 노드가 있지만 방사형 노드는 없지만 5f에는 다수의 평면과 원뿔형 노드가 있고 각 궤도는 하나의 방사형 노드를 가지고 있다는 것입니다.
주요 영역을 다루었습니다
1. 4F 궤도는 무엇입니까
- 정의, 일곱 궤도 및 상대적 유사성
2. 5F 궤도는 무엇입니까
- 정의, 일곱 궤도 및 상대적 유사성
3. 4F와 5F 궤도의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 4F와 5F 궤도의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 전자, 로브, 자기 양자 수, 노드, 핵, 궤도, 확률, 서브 쉘

4f 궤도는 무엇입니까
4f 궤도는 4 개의 전자 쉘 (에너지 레벨)의 7 개의 궤도입니다. 4F 궤도는 f 궤도의 첫 번째 부분 집합이다. 이것은 1, 2 및 3 전자 쉘에 궤도가 없음을 의미합니다. 이것은 아래에 s, p, d 및 f 궤도의 표에 나와 있습니다.
|
전자 쉘
|
궤도
|
|
1
|
s
|
|
2
|
s, p
|
|
3
|
s, p, d
|
|
4
|
s, p, d, f
|
|
5
|
s, p, d, f
|
4f 궤도 세트는 4 개의 다른 모양을 가지고 있으며 각각 다수의 평면 및 원뿔형 노드가 있습니다. 그러나 4F 궤도에는 방사형 노드가 없습니다. 7 개의 4F 궤도는 궤도의 평면에 따라 명명됩니다. 다음은 7 개의 4F 궤도입니다.
- 4f xyz
- 4f z3
- 4f z (x2-y2)
- 4f y (3 × 2-Y2)
- 4f x (x2-3y2)
- 4f xz2
- 4f yz2
이 궤도 중에서 4f xyz 및 4f z (x2-y2) 궤도에는 8 개의 엽이 있습니다. 그것들은 z 축 주위의 45 회전으로 서로 관련이 있습니다. 이것은 다른 요인에서도 비슷하지만 비행기에서 다르다는 것을 의미합니다.
나머지 7 개의 궤도 중 4f y (3 × 2-y2) 및 4f x (x2-3y2) 궤도는 z 축 주위에서 90을 회전시켜 서로 관련됩니다. 각각의 궤도에는 60 개의 로브가 60 개의 각도를 갖는 6 개의 엽이 있습니다. 4f xz2 및 4f yz2 궤도는 4f y (3 × 2-Y2) 와 유사하게 보입니다 및 4f x (x2-3y2) 6 개의 평면의 3 개의 결절 평면이 60 각도로 분리되지 않기 때문에 궤도는 다릅니다. 이 4f xz2 및 4f yz2 궤도에는 z 축에 6 개의 엽 중 2 개의 엽 중 2 개의 엽이 "콩 모양"이 있습니다. 반면, 4f xz2 궤도는 4f xz2 와 유사한 궤도입니다. 및 4f yz2 궤도, 그러나 "콩 모양의"로브는 X 축에 있습니다. 4f yz2 에서 궤도, "콩 모양의"궤도는 y 축에 있습니다.
5f 궤도는 무엇입니까
5f 궤도는 5 개의 전자 쉘 (에너지 레벨)의 7 개의 궤도입니다. 5F 궤도는 F 궤도의 두 번째 서브 세트입니다. 이 궤도는 궤도의 평면을 기반으로합니다. 7 개의 궤도는 다음과 같습니다.
- 5f xyz
- 5f z3
- 5f z (x2-y2)
- 5f y (3 × 2-Y2)
- 5f x (x2-3y2)
- 5f xz2
- 5f yz2
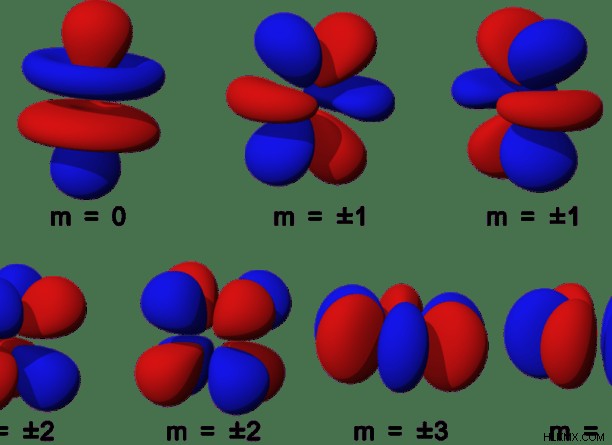
그림 1 :7 개의 다른 f 궤도
5F 궤도 세트에는 4 개의 다른 모양이 있으며 각각 다수의 평면 및 원뿔형 노드가 있습니다. 각 5F 궤도에는 하나의 방사형 노드도 있습니다.
이 궤도 중에서 5f xyz 및 5f z (x2-y2) 궤도에는 8 개의 엽이 있습니다. 그것들은 z 축 주위의 45 회전으로 서로 관련이 있습니다. 이것은 다른 요인에서도 비슷하지만 지시받는 평면에서 다르다는 것을 의미합니다.
나머지 7 개의 궤도 중 5f y (3 × 2-y2) 및 5f x (x2-3y2) 궤도는 z 축 주위에서 90을 회전시켜 서로 관련됩니다. 각각의 궤도에는 60 개의 로브가 60 개의 각도를 갖는 6 개의 엽이 있습니다. 5f xz2 및 5f yz2 궤도는 5f y (3 × 2-Y2) 의 궤도와 유사하게 보입니다 및 5f x (x2-3y2) 궤도이지만 6 개의 평면의 3 개의 결절 평면이 60 각도로 분리되지 않기 때문에 다릅니다. 이 5f xz2 및 5f yz2 궤도에는 6 개의 엽 중 2 개가 "콩 모양"이 있습니다. 반면에, 5f xz2 궤도는 5f xz2 와 유사한 궤도입니다. 및 5f yz2 궤도, 그러나 "콩 모양의"로브는 X 축에 있습니다. 5f yz2 에서 궤도, "콩 모양의"궤도는 y 축에 있습니다.
4F와 5F 궤도의 유사성
- 둘 다 궤도 형태입니다.
- 둘 다 같은 비행기에 비슷한 모양이 있습니다.
- 둘 다 복잡한 궤도 구조를 가지고 있습니다.
4F와 5F 궤도의 차이
정의
4f 궤도 : 4F 궤도는 4 번째 전자 쉘 (에너지 레벨)의 7 F 궤도입니다.
5f 궤도 : 5f 궤도는 5 번째 전자 쉘 (에너지 레벨)의 7 개의 궤도입니다.
서브 세트
4f 궤도 : 4F 궤도는 f 궤도의 첫 번째 하위 집합입니다.
5f 궤도 : 5f 궤도는 f 궤도의 두 번째 서브 세트입니다.
방사형 노드
4f 궤도 : 4F 궤도에는 다수의 평면과 원뿔형 노드가 있지만 방사형 노드는 없습니다.
5f 궤도 : 5F 궤도에는 다수의 평면과 원뿔형 노드가 있으며 각 5f 궤도에는 방사형 노드도 있습니다.
크기
4f 궤도 : 4F 궤도는 5F 궤도보다 작습니다.
5f 궤도 : 5F 궤도는 4F 궤도보다 큽니다.
결론
원자는 전자 껍질에 다른 형태의 궤도로 구성됩니다 :s 궤도, p 궤도, d 궤도 및 궤도. F 궤도의 추가는 4 개의 전자 쉘 (에너지 레벨)에서 시작됩니다. 4F와 5F 궤도의 주요 차이점은 4F 궤도에 다수의 평면과 원추형 노드가 있지만 방사형 노드는 없지만 5f에는 다수의 평면과 원뿔형 노드가 있고 각 궤도에는 하나의 방사형 노드도 있습니다.
. 참조 :
1. 마크 J 겨울. "원자 궤도 :4F (일반 세트)." 궤도 :2015 년 7 월 12 일, 원자 궤도 및 분자 궤도 갤러리.
2. 마크 J 겨울. "원자 궤도 :5F (일반 세트)." 궤도 :2015 년 7 월 12 일, 원자 궤도 및 분자 궤도 갤러리.
이미지 제공 :
1. Geek3의“F Orbitals M”-Commons Wikimedia를 통해 자신의 작업 (CC By-SA 3.0)









