엔트로피는 우주론, 생물학 및 경제학을 포함한 다른 분야에서 적용되는 물리 및 화학의 핵심 개념입니다. 물리학에서는 열역학의 일부입니다. 화학에서는 물리 화학의 일부입니다. 엔트로피 정의, 몇 가지 중요한 공식을 살펴보고 엔트로피의 예입니다.
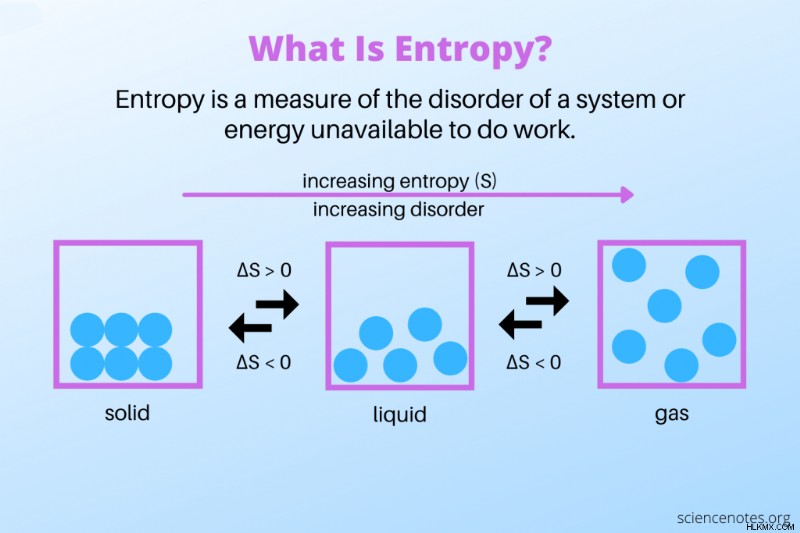
- 엔트로피는 시스템의 무작위성 또는 장애의 척도입니다.
- 그 상징은 대문자 S입니다. 전형적인 단위는 켈빈 당 줄입니다 (J/K).
- 엔트로피의 변화는 긍정적 (더 많은 무질서한) 또는 음성 (덜 무질서한) 값을 가질 수 있습니다.
- 자연계에서는 엔트로피가 증가하는 경향이 있습니다. 열역학 제 2 법칙에 따르면 시스템의 엔트로피는 다른 시스템의 엔트로피가 증가하는 경우에만 감소합니다.
엔트로피 정의
간단한 정의는 엔트로피가 시스템 장애의 척도라는 것입니다. 정렬 시스템의 엔트로피가 낮고 무질서한 시스템의 엔트로피가 높습니다. 물리학 자들은 종종 정의를 약간 다르게 언급합니다. 여기서 엔트로피는 작업을 수행 할 수없는 폐쇄 시스템의 에너지입니다.
엔트로피는 열역학적 시스템의 광범위한 특성이므로 존재하는 물질의 양에 따라 다릅니다. 방정식에서 엔트로피의 상징은 문자 S입니다. kelvin (j⋅k) 또는 kg⋅m⋅s⋅k 당 si 단위가 있습니다.
엔트로피의 예
엔트로피의 몇 가지 예는 다음과 같습니다.
- 평신도의 예로서, 깨끗한 방과 지저분한 방의 차이점을 고려하십시오. 깨끗한 방에는 엔트로피가 낮습니다. 모든 물체가 그 자리에 있습니다. 지저분한 방은 무질서하고 엔트로피가 높습니다. 지저분한 방을 깨끗한 방으로 바꾸려면 에너지를 입력해야합니다. 슬프게도, 그것은 결코 스스로를 청소하지 않습니다.
- 용해는 엔트로피를 증가시킵니다. 고체는 질서가있는 상태에서 더 무질서한 상태로 간다. 예를 들어, 설탕을 커피에 넣는 것은 설탕 분자가 덜 정리됨에 따라 시스템의 에너지를 증가시킵니다.
- 확산 및 삼투는 또한 엔트로피 증가의 예입니다. 분자는 자연적으로 고농도의 영역에서 평형에 도달 할 때까지 저농도의 영역으로 이동합니다. 예를 들어, 방의 한쪽 구석에 향수를 뿌리면 결국 모든 곳에서 냄새가납니다. 그러나 그 후, 향기는 자발적으로 병을 향해 움직이지 않습니다.
- 물질 상태 사이의 일부 위상 변화는 엔트로피가 증가하는 예이며, 다른 단계는 엔트로피 감소를 보여줍니다. 얼음 블록은 고체에서 액체로 녹아 엔트로피가 증가합니다. 얼음은 결정 격자에서 서로 결합 된 물 분자로 구성됩니다. 얼음이 녹 으면서 분자는 더 많은 에너지를 얻고 더 멀리 퍼지고 액체를 형성하기 위해 구조를 잃습니다. 마찬가지로, 위상은 물에서 증기까지 액체에서 가스로의 변화가 시스템의 에너지를 증가시킨다. 가스를 액체에 응축 시키거나 액체를 가스로 동결 시키면 물질의 엔트로피가 감소합니다. 분자는 운동 에너지를 잃고보다 체계적인 구조를 가정합니다.
엔트로피 방정식 및 계산
몇 가지 엔트로피 공식이 있습니다 :
가역적 공정의 엔트로피
가역적 프로세스의 엔트로피를 계산하면 프로세스 내의 각 구성이 똑같이 가능하다고 가정합니다 (실제로는 아닐 수도 있음). 결과의 동일한 확률이 주어지면 엔트로피는 Boltzmann의 상수와 같습니다 (k b ) 가능한 상태 수 (w)의 자연 로그를 곱한 것 :
s =k b ln w
등온 과정의 엔트로피
등온 과정의 경우, 엔트로피의 변화 ( ΔS )는 열의 변화와 같습니다 ( ΔQ )는 절대 온도 ( t 로 나뉩니다 ) :
ΔS = ΔQ / t
미적분학 적용, 엔트로피는 dq 의 적분이다 / t 초기 상태에서 최종 상태로, 여기서 q 열과 t 입니다 시스템의 절대 (켈빈) 온도입니다.
엔트로피 및 내부 에너지
물리 화학 및 열역학에서 유용한 엔트로피 공식 중 하나는 엔트로피와 시스템의 내부 에너지 (U)와 관련이 있습니다.
du = t ds - p dv
여기에서 내부 에너지의 변화 du 절대 온도 t 과 같습니다 엔트로피에서 외부 압력 p 의 변화를 곱한 및 부피의 변화 v .
엔트로피 및 열역학 제 2 법칙
열역학의 제 2 법칙에 따르면 폐쇄 시스템의 총 엔트로피는 감소 할 수 없습니다. 예를 들어, 흩어져있는 종이 더미는 자발적으로 깔끔한 스택으로 주문하지 않습니다. 캠프 파이어의 열, 가스 및 재는 결코 나무로 자발적으로 다시 조립되지 않습니다.
그러나 하나의 시스템의 엔트로피는 할 수 있습니다 다른 시스템의 엔트로피를 높이면 감소합니다. 예를 들어, 액체 물을 얼음으로 동결하면 물의 엔트로피가 감소하지만 상 변화가 열로 에너지를 방출함에 따라 주변의 엔트로피가 증가합니다. 문제가 폐쇄 시스템에 있지 않기 때문에 열역학 제 2 차 법칙을 위반하지 않습니다. 연구중인 시스템의 엔트로피가 감소하면 환경의 엔트로피가 증가합니다.
엔트로피 및 시간
물리학 자와 우주 학자들은 종종 엔트로피를“시간의 화살표”라고 부릅니다. 고립 된 시스템의 물질은 질서에서 장애로 이동하는 경향이 있기 때문입니다. 우주를 전체적으로 볼 때 엔트로피가 증가합니다. 시간이 지남에 따라 주문 된 시스템은 더욱 무질서하고 에너지 변화가 형성되어 궁극적으로 열로 손실됩니다.
우주의 엔트로피 및 열 사망
일부 과학자들은 우주의 엔트로피가 결국 유용한 작업이 불가능 해지는 지점까지 증가 할 것으로 예측합니다. 열 에너지 만 남아 있으면 우주는 열 사망으로 죽습니다. 그러나 다른 과학자들은 열 사망 이론에 이의를 제기합니다. 대체 이론은 우주를 더 큰 시스템의 일부로 본다.
소스
- Atkins, Peter; Julio de Paula (2006). 물리 화학 (8th ed.). 옥스포드 대학 출판부. ISBN 978-0-19-870072-2.
- Chang, Raymond (1998). 화학 (6th ed.). 뉴욕 :맥그로 힐. ISBN 978-07-115221-1.
- Clausius, Rudolf (1850). 열의 동기력과 열 이론을 위해 그로부터 추론 할 수있는 법률 . Poggendorff 's Annalen der Physick , lxxix (Dover Reprint). ISBN 978-0-486-59065-3.
- Landsberg, P.T. (1984). “엔트로피와“주문”이 함께 증가 할 수 있습니까?”. 물리학 편지 . 102a (4) :171–173. doi :10.1016/0375-9601 (84) 90934-4
- Watson, J.R.; Carson, E.M. (2002 년 5 월). "학부생의 엔트로피 및 깁스 자유 에너지에 대한 이해 관계." 대학 화학 교육 . 6 (1) :4. ISSN 1369-5614