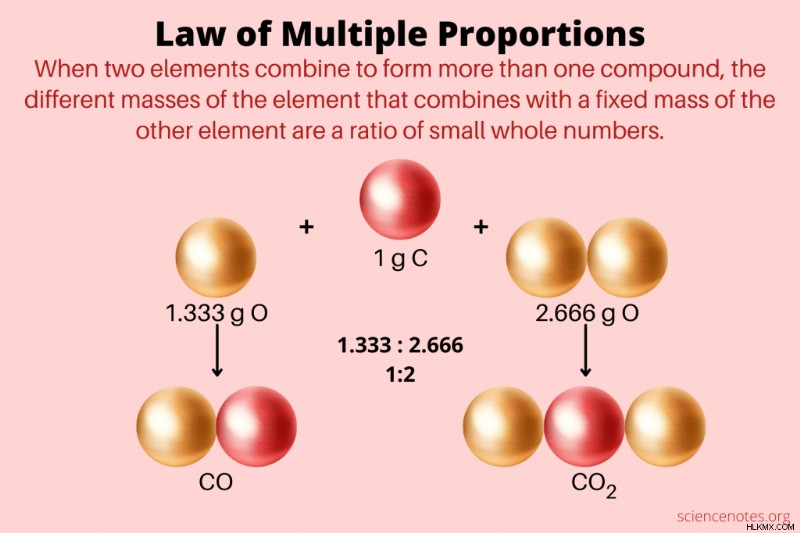
화학에서, 여러 비율의 법칙 두 원소가 하나 이상의 화합물을 형성 할 때, 다른 요소의 고정 질량과 결합하는 하나의 요소의 상이한 질량의 비율은 작은 정수의 비율이라고 말합니다. 여러 비율의 법칙의 또 다른 이름은 Dalton 's Law 입니다. John Dalton은 법을 묘사 한 최초의 화학자였습니다. 그러나 Dalton은 Dalton의 부분 압력 법칙을 공식화 했으므로“여러 비율의 법칙”이 선호하는 이름입니다.
여러 비율의 법칙의 예
예를 들어, Dalton은 다른 비율로 산소와 빗질하여 탄소가 2 개의 산화물을 형성한다는 것을 관찰했습니다. 예를 들어, 100 그램의 탄소 샘플은 133 그램의 산소와 반응하고 하나의 화합물 또는 266 그램의 산소를 형성하고 다른 화합물을 형성합니다. 100 그램의 탄소와 반응하는 산소 질량의 비율은 266 :133 =2 :1입니다. 이 데이터로부터 Dalton은 두 화합물에 대한 화학적 공식을 예측했다. .
다른 예로서, 질소는 산소와 반응하여 5 개의 상이한 질소 산화물을 형성한다. 14 그램의 질소와 결합 된 산소의 질량은 8, 16, 24, 32 및 40 그램입니다. 산소 질량의 비율은 1 :2 :3 :4 :5.
입니다여러 비율의 법칙
여러 비율 문제에 대한 두 가지 주요 유형의 법칙이 있습니다. 첫 번째 유형의 문제는 개념에 대한 이해를 테스트합니다. 다른 하나는 다른 요소와 함께 여러 화합물을 형성하는 요소들 사이에 적은 숫자 비율을 찾았습니다.
문제 #1
다음 중 여러 비율의 법칙을 보여주는 것은 무엇입니까?
- 평범한 물과 무거운 물
- 염화나트륨 및 브로마이드 나트륨
- 이산화황 및 삼중주
- 가성 소다와 가성 칼륨
정답은 이산화황과 삼중주가 법을 설명한다는 것입니다. 그 이유는 이것이 두 번째 요소 (산소)와 결합하여 하나 이상의 화합물을 형성하는 하나의 원소 (황)이기 때문입니다. 염화나트륨과 소듐 브로마이드 및 가성 소다 및 가성 칼륨은 두 가지 화합물을 포함하는 시나리오이지만 이들 화합물에는 동일한 두 원소가 포함되지 않습니다. 평범한 물과 헤비 워터는 서로 다른 수소 동위 원소를 사용하여 서로 같은 화합물입니다.
문제 #2
탄소 및 산소는 두 가지 화합물을 형성합니다. 첫 번째 화합물은 질량에 의한 42.9% 탄소 및 질량에 의한 57.1% 산소이다. 두 번째 화합물은 질량에 의한 27.3% 탄소 및 질량에 의한 72.7% 산소이다. 산소 질량 사이의 비율은 여러 비율의 법칙과 일치 함을 보여줍니다.
이 문제를 해결하기 위해, 고정 된 양의 탄소와 결합 된 질량 산소가 전량 비율임을 보여주십시오. 자신의 삶을 쉽게 만들고 각 샘플의 100 그램이 있다고 가정하십시오. 그런 다음 첫 번째 샘플에는 57.1 그램의 산소와 42.9 그램의 탄소가 있습니다. 따라서 탄소 그램 당 산소 (O)의 질량은 다음과 같습니다.
57.1 g o / 42.9 g c =1.33 g o 당 g c
100 그램의 샘플을 가정하면, 두 번째 화합물의 경우, 72.7 그램의 산소 (O) 및 27.3 그램의 탄소 (C)가 있습니다. 탄소 그램 당 산소 질량은 다음과 같습니다.
72.7 g o / 27.3 g c =2.66 g o 당 g c
이 방법으로 문제를 설정하면 고정 된 양의 탄소가 1 그램과 같습니다. 따라서 두 화합물에 대해 탄소 그램 당 산소량을 나누는 것입니다.
2.66 / 1.33 =2
다시 말해, 탄소와 결합 된 산소의 질량은 2 :1 비율입니다. 이 작은 정수 비율은 여러 비율의 법칙을 지원합니다.
여전히 정수 비율을 얻기 때문에 다른 방식으로 계산을 수행하더라도 (1.33 / 2.66 =1 / 2 또는 1 :2 비율) 중요하지 않습니다. 또한 실제 실험에서는 완벽한 데이터를 얻지 못할 것이며 약간의 반올림을해야 할 수도 있습니다! 예를 들어, 비율이 2.1 :0.9로 나오면 숫자를 반올림하여 2 :1 비율을 얻습니다.
여러 비율의 법칙 제한
여러 비율의 법칙은 간단한 화합물에 가장 잘 적용됩니다.
모든 상황에서 잘 작동하지 않거나 모든 화합물에도 적용됩니다. 구체적으로, 비-지리 틱 화합물, 올리고머 및 폴리머에 대해서는 실패한다. 수소를 함유 한 더 큰 분자에는 적합하지 않습니다. 수소는 작은 질량을 가지고있어 반올림 오류가 종종 잘못된 비율을 제공하고 수소 질량 사이의 비율은 항상 작은 수치가 아닙니다.
예를 들어, 탄소 및 수소는 탄화수소 데칼을 형성합니다 (C 10 H 22 ) 및 UNDECANE (c 11 h 24 ). 100 그램의 탄소의 경우, 데케인은 18.46 그램의 수소를 가지며 미개산에는 18.31 그램의 수소가 있습니다. 두 화합물 사이의 수소 질량의 비율은 121 :120이며, 이는 작은 수의 비율이 아닙니다.
역사
여러 비율의 법칙은 Dalton의 원자 이론과 관련이 있기 때문에 중요합니다. 그러나 Dalton이 여러 비율의 법칙을 관찰 한 다음 그의 원자 이론을 공식화하는 데 사용했는지 또는 이론이 먼저 왔는지 여부는 불분명합니다.
.Dalton은 처음으로 법을 설명했지만, 그는이 법을 관찰 한 최초의 화학자가 아니 었습니다. 1792 년에 Bertrand Pelletier는 고정 된 양의 산소가 한 가지 유형의 산화물을 형성하고 2 배의 산소 (1 :2의 비율)는 다른 산화물을 형성한다고 지적했다. Joseph Proust는 Pelletier의 관찰을 확인하고 화합물의 상대적인 주석 및 산소를 측정했습니다. Proust는 법을 발견하는 데 필요한 정보를 가지고 있었지만 그의 발견을 일반화하지 않았습니다.
참조
- Pelletier, Bertrand (1792). “관찰 Sur Plusieurs Propriétés du muriate d 'étain”[주석의 무리의 다양한 특성에 대한 관찰]. Annales de Chimie (프랑스어로). 12 :225–240.
- Petrucci, Ralph H.; Harwood, William S.; 청어, F. Geoffrey (2002). 일반 화학 :원리 및 현대 응용 (8th ed.). 상단 새들 강, 뉴저지 :프렌 티스 홀. ISBN 978-0-13-014329-7.
- Proust, Joseph Louis (1800). “RECHERCHES SUR L 'ETAIN”[TIN에 대한 연구]. Journal de Physique, de Chimie, et d 'Histoire Naturelle (프랑스어로). 51 :173–184.
- Roscoe, Henry E.; Harden, Arthur (1896). 달튼 원자 이론의 기원에 대한 새로운 견해 . Macmillan and Co.