주요 차이-알킬화 vs 아실화
알킬화는 알킬 그룹을 알킬화 제를 사용하여 알킬기를 다른 분자로 전달하는 것입니다. 이 알킬화제 원하는 지방족 탄화수소 사슬을 출발 물질에 추가 할 수 있습니다. 알킬화와 달리, 아실화는 아실화 제를 사용하여 화합물에 아실기를 첨가하는 과정이다. 이 아실화제 원하는 rco-group을 시작 재료에 추가 할 수 있습니다. 이것이 주요 차이 입니다 알킬화와 아실화 사이.
알킬화
알킬화는 탄화수소 체인을 시작 재료에 도입하는 과정입니다. 탄화수소는 탄소 및 수소 원자로 구성된 가장 일반적인 유형의 유기 화합물입니다. 출발 물질에 하나의 탄소 원자 (메틸기)를 첨가하는 것은 메틸화로 알려져 있습니다.
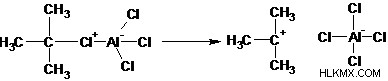
알킬 그룹은 알킬 탄수화물, 자유 라디칼, 카바이온 또는 카르 빈으로 전송 될 수 있습니다. 따라서, 알킬화 제는 주로 전자 성 및 친 핵성 특성에 기초하여 두 가지 범주로 나눌 수있다. 친 핵성 알킬화 제는 반응 동안 알킬 음이온 (Carbanion)을 형성하고 카르 보닐기와 같은 전자 결핍 탄소 원자를 형성한다. (예 :Grignard, Organolithium, Organocopper 및 Organosodium 시약). 전주성 알킬화 제는 반응 동안 알킬 양이온 (Carbocation)을 형성한다 (예 :알킬 헬라이드). 다음 반응은 벤젠의 Friedel-Crafts 알킬화 메커니즘을 보여줍니다.
1 단계 : 알킬 할라이드는 루이스 산과 반응하여 더 많은 경사체 탄소를 생성합니다. 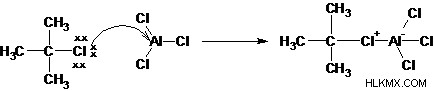
2 단계 : 할라이드를 제거하면 알킬 탄수화물이 생성됩니다.
3 단계 : 방향족 고리의 π 전자는 친핵체 역할을하며, 방향족을 잃어버린 채로를 공격한다. 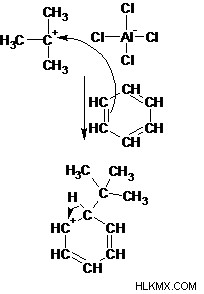
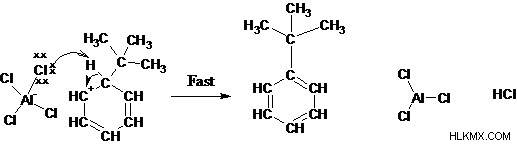
4 단계 : 양성자 제거는 방향족 시스템을 재생시킨다
아실화
아실화는 아실화 제를 사용하여 시작 재료에 아실 그룹을 첨가하는 과정입니다. 아실 그룹은 RCO의 분자 공식을 갖는 기능 그룹입니다.
아실화 제는 금속 촉매로 처리 될 때 강한 전기성을 형성하고 쉽게 전자 성 치환을 겪습니다. 아실 할라이드는 가장 일반적으로 사용되는 아실화 제이며, 전자 유전 적 치환에 의해 케톤을 생성합니다. 또한, 카르 복실 산의 아실 할라이드 및 무수물은 친 핵성 치환에 의해 아실 레이트 아민 및 알코올에 대한 아실화 제로서 사용된다. 다음 반응은 벤젠의 Friedel-Crafts 아실화 메커니즘을 보여줍니다.
1 단계 : 아실 할라이드는 루이스 산과 반응하여 복합체를 생성합니다. 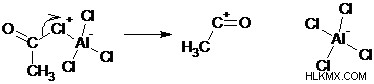
2 단계 : 아실 할라이드로부터의 할라이드의 손실은 경사 성 아실륨 이온을 생성한다.

3 단계 : 벤젠의 π 전자는 친핵체로서 작용하고 전자 성 아실륨 이온에 대한 공격을한다. 이 단계는 Cyclohexadienyl 양이온 중간체를 제공하는 방향족을 파괴합니다. 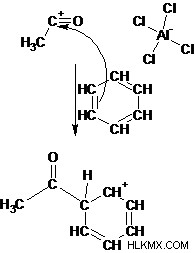
4 단계 : 양성자 제거는 방향족 시스템과 활성 촉매를 재생시킨다. 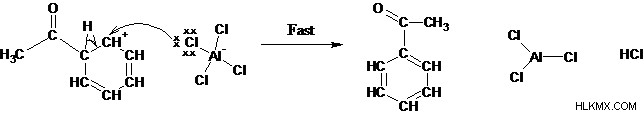
알킬화와 아실화의 차이
정의
알킬화 :알킬화는 탄화수소 사슬을 출발 물질에 도입하는 과정입니다.
아실화 :아실화는 아실화 제를 사용하여 시작 물질에 아실기를 첨가하는 과정입니다.
전체 변환
알킬화 : 전체 변환은 R-H에서 R-R입니다.
아실화 : 전체 변환은 R-H에서 R-Cor입니다.
시약
알킬화 : 일반적으로 알루미늄 트리클로 라이드와 같은 알킬 할라이드 (즉, R-Cl) 및 루이스 촉매 (즉, Alcl 3 ) 시약 역할을 할 수 있습니다. 대안 적으로, 유기-금속 복합체, 즉 R-MGBR이 알킬 할라이드 대신 사용될 수있다. 또한, bf 3 , zncl 2 , fecl 3 alcl 3 대신 사용할 수 있습니다.
acylation : 일반적으로 아실 할라이드 (즉, R-CoCL) 및 알루미늄 트리클로 라이드와 같은 루이스 촉매는 시약으로서 작용한다. 대안 적으로, 산 무수물, 즉 (rco)
전자성 종
알킬화 : 탄수화물 (I.E . r)는 Lewis Acid Catalyst에 의해 할라이드의 "제거"에 의해 형성됩니다.
acylation : 아실 양이온 또는 아실륨 이온 (즉, . RCO)는 Lewis Acid Catalyst에 의해 할라이드의 "제거"에 의해 형성됩니다.
탄수화물 재 배열
알킬화 : 탄수화물은 재 배열되기 쉽고 매우 안정적인 탄수화물을 형성하여 알킬화 반응을 겪게됩니다.
acylation : 아실륨 이온은 공명 구조에 의해 안정화된다. 이 추가 안정성은 탄수화물의 재 배열을 방지합니다.
Friedel-Craft 반응
알킬화 : 비닐 또는 아릴 할라이드는 중간 탄수화물이 불안정하기 때문에 알킬화 반응을 겪지 않습니다.
acylation : HCOCL은 반응 조건 하에서 CO 및 HCL로 분해되기 때문에 아실화 반응은 항상 케톤을 제공한다.