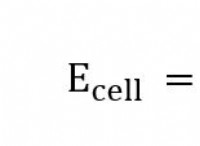Abegg의 규칙 요소의 최대 양성과 음의 원자가의 차이는 일반적으로 8이라고 말합니다. 이 규칙의 또 다른 이름은 "Abegg의 원자가와 대응 법칙"입니다. 독일 화학자 Richard Abegg는 1904 년 에이 규칙을 제안했습니다.
Abegg의 규칙의 예
예를 들어, 원소 황 (s)의 음의 원자가는 화합물 h 2 에서 -2입니다. s와 그 양의 원자가 (카운터 원자가)는 h 2 에서 +6입니다. 그래서
Abegg의 규칙이 어떻게 작동하는지
Abegg의 규칙과 관련하여, 원자가는 원자가 전자 공여체 또는 수신기 역할을하는지 여부를 설명합니다. 이것은 산화 상태의 현대 개념과 일치합니다. 예를 들어, 그룹 5 요소는 펜타 볼트 (5 개의 원자가 전자)입니다. 그룹 5 (예를 들어, 바나듐, 니오 비움, 탄탈 룸)의 원자는 전자 공여자 (-3)로서 작용하거나 전자 수용체 (+5)로서 작용할 수있다. 어느 상황에서도, 원자는 화학적 결합을 형성 할 때 안정적인 옥셋을 달성합니다. 정상 원자가 (-3)와 콘트라 원자가 (+5)의 차이는 8입니다.
Abegg의 규칙에 대한 예외
Abegg의 "규칙"은 가이드 라인에 가깝습니다. 모든 요소에 효과가있는 것은 아닙니다. 명백한 예외는 수소이며, 이는 +1에서 -1 사이의 원자가입니다. 다시 말해, 수소 원자는 단일 전자를 얻거나 잃는다. 단일 양성자의 경우, 수소는 옥틴에 충분한 전자를 수용 할 수있는 핵이 없습니다.
Octet 규칙을 위반하는 다른 요소는 때때로 Abegg의 규칙을 위반하는 경우가 있습니다. 예를 들어, 실리콘, 인, 황 및 염소의 원소는 때때로 4 개 이상의 원자에 결합합니다. 그들은 SP 옥넷을 만족시키는 것 이상으로갑니다. 이 요소로부터의 원자에는 결합에 참여할 수있는 5 개의 5 개의 궤도가 있습니다. Abegg의 규칙에 "짝수"규칙을 적용하면 확장 된 옥트 예외가 도움이됩니다.
원자는 옥트 규칙을 위반할 수 있으며 (옥넷이 확장 됨) Abegg의 규칙을 여전히 만족시킬 수 있습니다. 황 6 헥사 플루오 라이드의 경우 (sf 6 ), 황은 불소 원자를 고정하기위한 12 개의 결합 전자 (+6) 및 결합을 갖는다. 황의 정상적인 원자가는 -2이고, 콘트라 원자가는 +6이고, 차이는 8입니다.
일부 원자는 +8보다 큰 산화 상태를 가질 수 있습니다. 예를 들어, 이리듐의 산화 상태는 [pto 4 에서 -3 내지 +10입니다. ]. 이 원자는 Abegg의 규칙에 대한 예외입니다.
Abegg의 규칙의 중요성
Abegg의 규칙은 다른 과학자들에게 미치는 영향으로 인해 중요합니다. Gilbert N. Lewis는 그의 입방체 원자 이론 (1916)에 Abegg의 규칙을 적용했으며, 결국 옥타 규칙의 발전으로 이어졌습니다. Linus Pauling의 영향력있는 1938 년 텍스트, 화학 결합의 본질은 Abegg와 Lewis의 작업을 그렸습니다.
참조
- Abegg, R. (1904). “Die Valenz und das Teagerische 시스템. Versuch Einer Theorie der Molekularverbindungen”[밸런스 및 주기율표. 분자 화합물 이론에 대한 시도]. Zeitschrift für Anorganische Chemie (독일어). 39 (1) :330–380. doi :10.1002/zaac.19040390125
- auvert, Geoffroy (2104). “화학 구조 공식에서“고른”규칙을 사용한 Lewis-Abegg-Octet 규칙의 개선 :주요 그룹 요소를 갖는 안정적인 기존의 기체 단일 결합 분자의 hypo에 대한 적용 및 고소득”. 개방적인 물리 화학 저널. 4 (2) :60-66. doi :10.4236/ojpc.2014.42009
- Housecroft, Catherine E.; Sharpe, Alan G. (2005). 무기 화학 (제 2 판). 피어슨 교육 제한. ISBN 0130-39913-2.
- Lewis, Gilbert N. (1916-04-01). “원자와 분자”. 미국 화학 학회지 저널 . 38 (4) :762–785. doi :10.1021/ja02261a002
- Pauling, Linus (1960). 화학 결합의 성질과 분자 및 결정의 구조; 현대 구조 화학 소개 (제 3 판). 코넬 대학 출판부. ISBN 0-8014-0333-2.
- Ritter, Stephen K. (2016). “산화 상태 +10 가능성”. c &en . 94 (25).