화학에서 분자 내 힘 분자에서 원자를 함께 유지하고 있습니까? 이 힘은 동일한 분자의 다른 부분 내에서 작용하고 화학 결합을 통해 원자를 연결합니다. 대조적으로, inter 분자 력은 별도의 분자 사이에 작용합니다. 일반적으로, 분자 내 힘은 원자에 결합하지만, 힘은 원자, 단일 원자 또는 양성자 및 전자를 포함한 원자의 일부를 포함 할 수있다.
분자 내 힘의 작동 방식
분자 내 힘의 기초는 전하와 유사한 전하의 반발과는 달리 매력입니다. 전하와는 달리 음으로 충전 된 전자 및 양의 차전 된 양성자입니다. 요금은 별도의 원자 핵 또는 다른 전자입니다. 화학적 결합이 형성 될 때, 원자 핵 주위의 전하 분포는 원자 자체가 존재하는 방식과 다릅니다. 전자는 원자의 핵을 둘러싸더라도 인접한 원자의 핵을 방출하고 이웃 전자를 끌어들이는 것을 완전히 보호하지는 않습니다. 마찬가지로, 원자 주위의 전자는 다른 원자 주위의 전자를 회전시키고 다른 핵에 대한 인력을 느낍니다. 이들 힘 사이의 상호 작용은 화학 결합 원자의 유형과 분자의 화학적 및 물리적 특성을 결정한다.
분자 내 힘의 유형
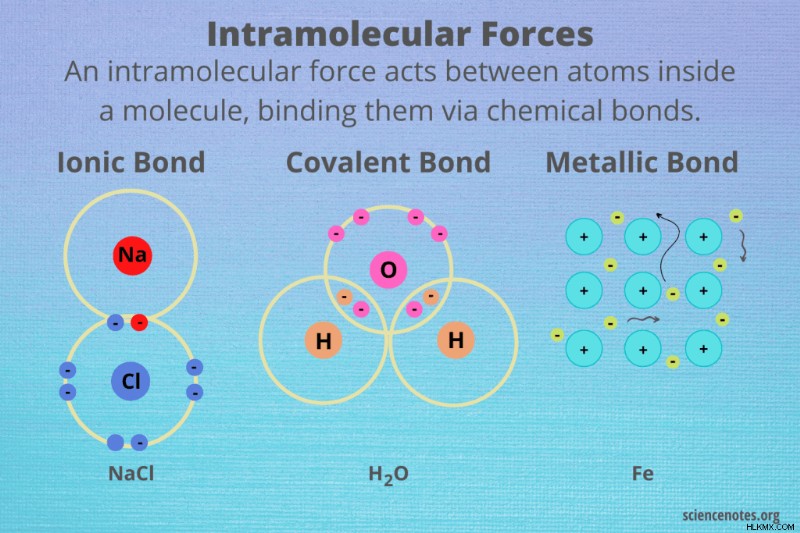
분자 내 힘의 유형은 화학적 결합의 세 가지 주요 유형, 즉 이온 결합, 공유 결합 및 금속 결합입니다. 이러한 유형의 결합 사이의 구별은 결합을 형성하는 원자 사이의 전하 분리 정도입니다. 그러나 원자들 사이의 전기 음성 차이는 전하 분리의 좋은 예측 인자입니다.
- 이온 결합 :이온 결합은 하나의 원자에서 다른 원자의 원자가 쉘로 하나 이상의 전자를 완전히 전달하는 것을 포함한다. 염화나트륨 (NaCl 또는 테이블 소금)에서 나트륨과 염소 사이에 형성되는 결합은 좋은 예입니다. 여기서 나트륨 원자가 원자가 전자를 염소 원자에 기증합니다. 이온 결합은 전기 음성 차이가 큰 원자 사이에 형성됩니다. 일반적으로 금속은 비금속과 이온 결합을 형성합니다.
- 공유 결합 :원자는 전자를 공유 결합으로 공유합니다. 대부분의 공유 결합은 동일하거나 비슷한 전기성을 갖는 비금속 원자 사이에 형성됩니다. 예를 들어, 산소 원자는 산소 가스에서 서로 공유 결합을 형성합니다 (O 2 ). 수소는 물의 산소와 공유 결합을 형성합니다 (H 2 영형). 원자가 동일한 전기성을 가질 때, 결과는 비극성 공유 결합이다. 비금속 원자가 유사한 비 동일성 전기 성분을 갖는 경우 결과는 극성 공유 결합입니다.
- 금속 결합 :금속 결합은 자유 원자가 전자를 갖는 금속의 원자 사이에 형성됩니다. 따라서 금속 결합은 순수한 금속 요소 (금,은, 구리)와 합금 (황동, 청동, 스털링 실버)에서 발생합니다. 이온 성 및 공유 결합에 참여하는 전자는 특정 파트너 원자와 관련이있는 반면, 금속 결합의 전자는 비편 화된다. 즉, 그들은 여러 원자 사이를 자유롭게 흐릅니다. 금속 결합은 주로 특정 공유 결합에 형성된 공명 구조와 유사합니다. 공유 결합에서와 같이, 금속 결합을 형성하는 원자의 전기성이 거의 없거나 전혀 없다. .
는 분자간 힘이 분자 내 힘보다 강하다?
분자 내 힘은 분자간 힘보다 강합니다. 이온 결합은 가장 강력한 분자간 힘 인 경향이 있지만 예외가 있습니다. 예를 들어, 다이아몬드의 탄소 원자 사이의 공유 결합은 매우 강합니다. 결합 강도는 여러 요인에 따라 다릅니다. 예를 들어, 분자 내에서, 특정 결합의 강도는 분자의 다른 결합에 의해 영향을 받는다. 이온 성 및 공유 결합의 혼합물을 함유하는 분자는 순수한 이온 성 또는 순수한 공유 분자보다 분자간 힘 (약한 결합)을 갖는 경향이있다. 금속 결합은 일반적으로 이온 성 또는 공유 결합보다 약하지만 예외가 있습니다. 가장 강한 분자간 힘은 수소 결합입니다. 따라서 가장 강한 것에서 가장 약한 분자 내 힘을 대략적으로 순위에 올랐다 :
- 이온 결합
- 극성 공유 결합
- 비극성 공유 결합
- 금속 결합
- 수소 결합 (비교를위한 분자간)
참조
- Bader, R.F.W.; Henneker, W. H. (1965). "이온 결합." 미국 화학 학회지 저널 . 87 (14) :3063–3068. doi :10.1021/ja01092a008
- iupac (2019). "분자 내." 화학 용어의 개요 (“골드 북”) (2 판). 옥스포드 :Blackwell Scientific Publications. ISBN 0-9678550-9-8. doi :10.1351/Goldbook
- 킹, 말차 (1976). "화학 결합의 이론". jacs . 98 (12) :3415–3420. doi :10.1021/ja00428a004
- Oxtoby, David W.; Gills, H.P.; Campion, Alan (2012). 현대 화학의 원리 (7th ed.). Belmont, Calif. :Brooks/Cole Cengage Learning. ISBN 978-0-8400-4931-5.
- Zumdahl, Steven S.; Zumdahl, Susan A. (2007). 화학 (7th ed.). 보스턴 :Houghton Mifflin. ISBN 978-0618713707.