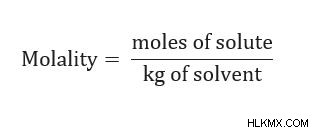핵심 개념
Molality에 대한이 튜토리얼에서는 용액의 농도를 이해할 때 정의, 중요성 및 Molality를 계산하는 방법을 배웁니다. 예제 계산이 제공됩니다.
다른 기사에서 다루는 주제
- Molarity
- 혼합물
- 두더지는 무엇입니까?
- 차원 분석
- 화학량 측정법
어휘
- molality (m) :태양의 질량 당 용질의 두부 수를 사용한 농도 측정 t
- 솔루션 :용질 및 용매를 포함하는 균질 혼합물
- Colligative Properties : 용질 이온의 농도에 의존하는 용액의 특성
- Molarity (M) : 용액의 리터 당 용질의 두부 수를 사용한 농도 측정
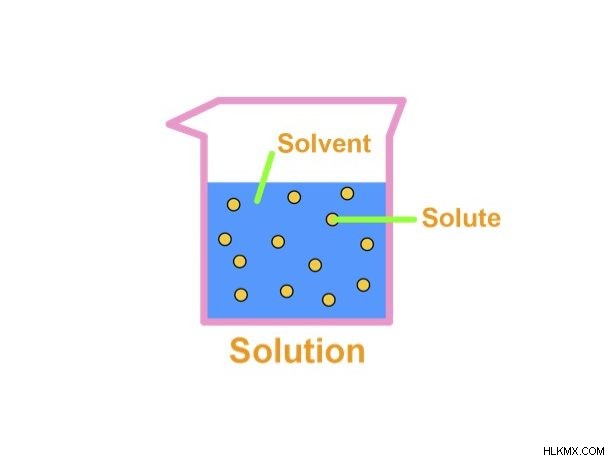
솔루션 기본
용액은 균일하게 혼합 된 혼합 또는 균질 한 구성 요소와 혼합물입니다. 또한, 이들 혼합물은 모든 물질 상태로 만들어 질 수있다. 솔루션은 용질과 용매의 두 가지 구성 요소로 구성됩니다. 용질은 용액의 사소한 또는 용해 된 부분입니다. 이에 비해 용매는 용질을 용해시킨다. 예를 들어, 물의 용액에서 소금은 용질이고 물은 용매입니다.
몰 리티 란 무엇입니까?
몰라도, 또는 몰 농도는 용질의 두부 수를 용매 질량으로 나눈 를 나타냅니다. , 킬로그램에서, mol ∕ kg. 이 용어는 공식이 온도와 압력과 무관하기 때문에 용액의 농도를 이해하는 데 유용합니다. 따라서, 공동 특성은 몰에 의존한다. 공동 특성에는 끓는점 상승, 동결 지점 우울증, 증기 압력 하강 및 삼투압이 포함됩니다.
계산 몰 리티
공식 : m =용질의 mol/ kg의 용매
예 :75kg의 물 샘플에서 52g의 테이블 소금 (NaCl) 샘플의 몰이는 무엇입니까?
이 예에서, 용질 (표 염) 및 용매 (물)의 질량이 제공된다. Molality Formula (mol/kg)의 단위를 사용하여 예제 문제의 성분에 올바른 단위가 있는지 확인하십시오. 이 예에서, 용질의 두더지의 수는 제공되지 않지만, 용질의 알려진 질량으로, 용질의 몰의 수를 결정할 수있다. NaCl의 두더지 수를 계산하려면 NaCl의 몰 질량을 사용하십시오. NaCl의 1 몰에는 58.44 그램의 NaCl이 있습니다. 알려진 NaCl 의이 몰 질량을 사용하면 그램에서 두더지로의 전환은 치수 분석을 통해 계산 될 수 있습니다.
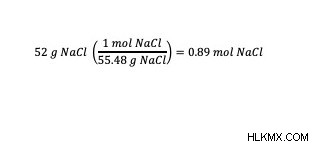
Molality 공식을 되돌아 보면 올바른 단위는 mol/kg입니다. 올바른 단위를 갖는 용매의 질량은 문제에 제공되므로 치수 분석이 필요하지 않습니다. 따라서 용액의 질량에 의해 용질의 두더지의 수를 나누어 용액의 몰을 계산합니다.
.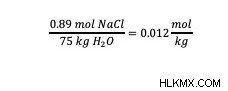
몰이 및 몰이성
마찬가지로, 몰토리성은 용액의 농도를 계산하는 데 유용합니다. Molarity는 용액 당 용질의 두부 수를 측정합니다. , mol ∕ L 또는 1 리터의 용액 당 두더지 수. 또한, 은밀도는 온도에 의존하며 공동 특성에 의해 영향을받습니다.
| Molarity | molality |
| 라이트에서 용액의 부피 대 용질의 비율 | 킬로그램에서 용매 질량에 대한 용질의 두부의 비율 |
| ‘m’ | 로 표시됩니다‘m’으로 대표됩니다 |
| m =용액/ 리터의 용액 | m =용질의 용질/킬로그램의 용매 |
| 는 전체 솔루션 의 볼륨에 따라 다릅니다 | 는 용매 의 질량에만 의존합니다 |
| 압력과 온도에 따라 | 압력 및 온도의 변화와 무관 |
| 단위 :mol/l | 단위 :mol/kg |