핵심 개념
이 튜토리얼에서는 분해 반응이 무엇인지 그리고 그 유형을 배우게됩니다. 당신은 또한 매혹적인 예를 탐구하게 될 것입니다!
다른 기사에서 다루는 주제
- 화학 반응이란 무엇입니까?
- 유형의 화학 반응
- 균형 화학 방정식
- 흡열 대 발열 반응
- 물리적 및 화학적 특성
분해 반응이란 무엇입니까?
분해 반응은 출발 화합물이 2 개 이상의 단순한 성분으로 분해되는 화학 반응이다. 이 단순한 구성 요소는 원소 또는 화합물 또는 둘 다일 수 있습니다. 분해 반응의 일반적인 공식은 다음과 같습니다.
ab → a + b
(AB는 반응물입니다. A와 B는 제품입니다)
분해 반응은 일반적으로 흡열 입니다 화학 결합의 파괴에는 에너지의 입력이 필요하기 때문입니다. 그렇습니다. 제품의 형성은 새로운 결합을 형성 할 때 에너지를 방출하지만, 그러한 에너지는 일반적으로 반응물의 결합을 파괴하는 데 사용되는 초기 에너지를 보상하기에 충분하지 않습니다.
그러나 제품의 결합 형성 에너지가 반응물의 결합-파괴 에너지보다 큰 드문 경우 (반응물이 반응성이 높기 때문에) 분해 반응은 발열 될 수 있습니다. 우리가 나중에 탐구 할 과산화수소의 분해는 그러한 사례 중 하나입니다.
분해 반응 유형
분해 반응을 시작하려면 에너지의 입력이 필요하다고 말했을 때 기억하십니까? 에너지의 입력은 열, 빛 또는 전기 일 수 있습니다.
열 분해 (열분해)
열분해는 열이 화합물을 화학적으로 분해 할 때 발생합니다. 즉, 열은 반응물입니다. 우리는 반응을 얻기 위해 열을 공급합니다.
예를 살펴 보겠습니다 :탄산 칼슘의 분해 (caco 3 ).
caco 3 (S) + δ → Cao (S) + Co 2 (g) (δ는 열을 나타냅니다)
(컴퓨터에서 δ를하기가 더 쉽기 때문에 δ를 반응물로 넣습니다. 반응 화살표에 δ를 넣는 것이 완벽합니다. 아래의 hν에 대해서도 마찬가지입니다.)
.
실생활 에서이 반응을 수행하려면 Caco
Photodecomposition (photoleysis)
광분해는 빛 (또는 더 구체적으로 광자)이 화합물을 화학적으로 분해 할 때 발생합니다. 광분해의 예는 식물의 광합성 과정의 빛 의존적 반응에서 찾을 수 있습니다 :
h 2 O + Hν → 2 H + 2 E + 1/2 O 2 (Hν는 빛을 나타냅니다)
여기서, 물은 빛 (구체적으로 2 개의 광자)을 흡수하고 양성자 (H), 전자 (E) 및 분자 산소로 분해된다.
전기 분해
전기 분해 전용 기사가 있습니다 :전해 세포 및 전기 분해! 이 전기 기술에 대해 더 알고 싶다면 확인하십시오.
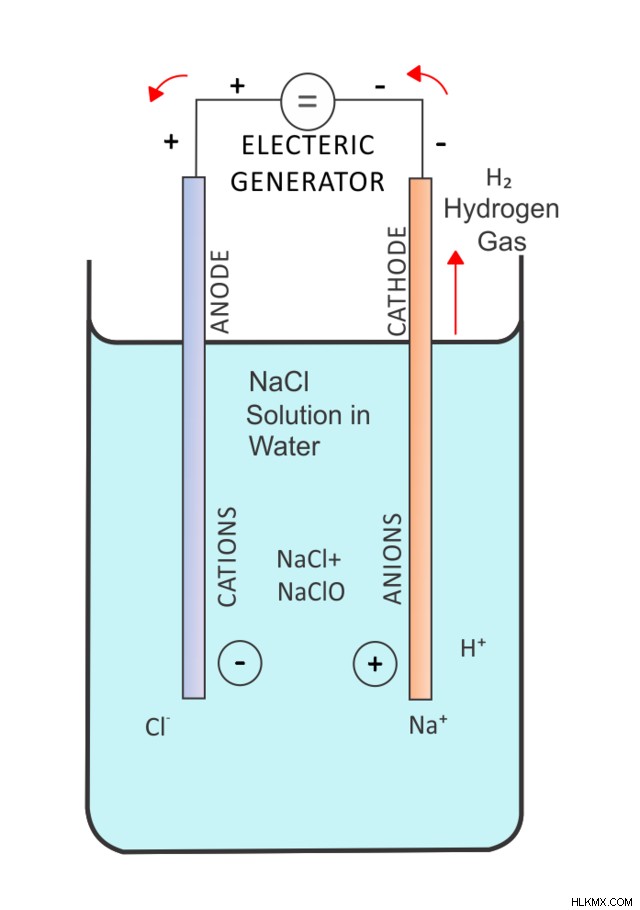
어쨌든, 전기 분해는 전기가 화합물을 화학적으로 분해 할 때 발생합니다. 전기 분해 반응은 2 개의 동시 반 반응 (환원 반응 및 산화 반응)의 조합입니다.
예를 살펴 보겠습니다 :클로라이드 나트륨 (NACL)의 전기 분해.
2 NaCl (L) → 2 NA (L) + Cl 2 (g)
이 반응에서, NaCl은 액체 나트륨 금속 및 염소 가스로 분해된다. 관련된 2 개의 반 반응은 Na 이온의 감소와 Cl 이온의 산화이다.
분해 반응의 예
앞서 약속 한 바와 같이, 과산화수소의 분해를 탐색합시다 (H 2 o 2 ).
2 h 2 o 2 (aq) → 2 H 2 o (l) + o 2 (g)
과산화수소의 산소-산소 결합은 매우 불안정하기 때문에, 병에 저장된 과산화수소는 항상 물과 산소 가스로 분해됩니다. 그러나 더 재미있는 (그리고 위험한) 무언가를 원한다면, 칼륨 과망간산염과 같은 촉매를 사용하여 분해 속도를 높이십시오 (kmno 4 . ), 아래 비디오와 같이. 이러한 반응은 매우 발열 적입니다. 매우 높은 온도에 도달하고 많은 가스를 방출 할 수 있습니다 (대부분은 수증기입니다). 따라서, 그렇게 할 자격이 없다면 집에서 반응을 수행하지 마십시오.
그건 그렇고, 과산화수소의 분해는 또한 코끼리 치약을 만드는 데 중요한 역할을합니다!
또 다른 대중적인 분해 반응은 금속 수산화물의 분해 입니다. . 금속 수산화물은 가열시 금속 산화물과 물로 분해됩니다. 다음은 몇 가지 예입니다.
- hydroxide 나트륨의 분해 :2 naoh (s) + δ → na 2 o (s) + h 2 o (g)
- 칼슘 수산화 칼슘 :ca (OH) 2 + δ → Cao + H 2 o
- 철 (III) 수산화물 :2 Fe (OH)
3 + δ → Fe 2 o 3 + 3 h 2 o
추가 판독
- 연소 반응
- 화학 반응 인포 그래픽
- 전기 화학이란 무엇입니까?
- 백키 원소 칼슘