크세논은 원자 번호 54 및 요소 기호 XE를 가진 화학 요소입니다. 요소는 고귀한 가스이므로 불활성, 무색, 무취, 맛이없고 무독성입니다. 크세논은 고출력 램프에서 사용하는 것으로 가장 잘 알려져 있습니다. 다음은 흥미로운 크세논 사실의 모음과 발견, 용도 및 출처의 역사와 함께.
크세논 요소 사실
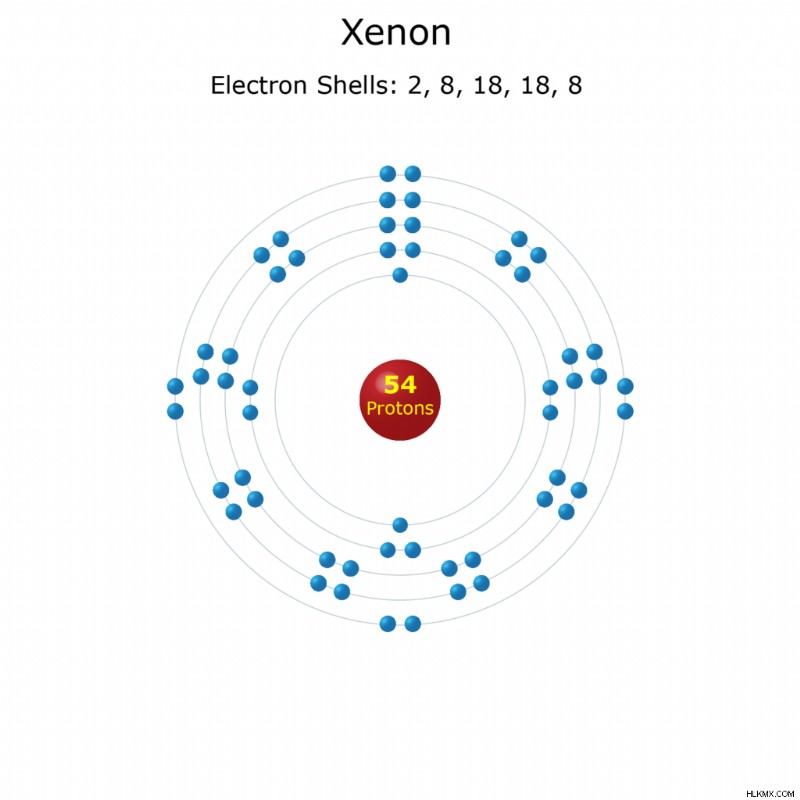
이름 :크세논
원자 번호 :54
요소 기호 :xe
외관 :무색 가스
그룹 :그룹 18 (고귀한 가스)
기간 :기간 5
블록 :p- 블록
요소 가족 :고귀한 가스
원자 질량 :131.293 (6)
전자 구성 :[KR] 4D 5S 5p
쉘 당 전자 :2, 8, 18, 18, 8
발견 :William Ramsay와 Morris Travers (1898)
이름 원점 :그리스어 Xenos , 낯선 사람을 의미
발견의 역사
스코틀랜드 화학 윌리엄 램지 (William Ramsay)와 영어 화학자 모리스 트래버스 (Morris Travers)는 1898 년 9 월에 Xenon을 분리하고 발견했습니다. 그들은 이미 산업 주의자 Ludwig Mond가 선물 한 액체 공기 기계를 사용하여 고귀한 가스 크립톤과 네온을 발견했습니다. 액화 공기를 증발시키고 잔류 물을 검사함으로써 얻어진 크세논. 그들이 가스를 진공 튜브에 넣었을 때, 그 놀라운 푸른 빛이 관찰되었습니다. Ramsay는 그리스어 단어 "Xenos"에서 새로운 요소의 이름을 제안했습니다. Ramsay는 Xenon이 액화 공기의 샘플에서 낯선 사람으로 묘사했습니다.
크세논 동위 원소
천연 크세논은 XE-126, XE-128, XE-129, XE-13, XE-131, XE-132 및 XE-134의 7 가지 안정적인 동위 원소로 구성됩니다. XE-126 및 XE-134는 이론적으로 이중 베타 붕괴를 겪지 만 관찰 된 적이 없다. 40 개가 넘는 방사성 동위 원소가 설명되었습니다. 가장 긴 수명의 방사성 동위 원소는 XE-124이며 반감기는 1.8 × 10 세입니다.
생물학적 역할과 독성
원소 크세논은 무독성이며 생물학적 역할을하지 않습니다. 그러나 Xenon은 혈액에 용해되어 혈액 뇌 장벽을 가로 질러 마취제 역할을합니다. 크세논 산소 혼합물을 호흡 할 수는 있지만 산소보다 무겁기 때문에 크세논에 의해 질식 될 수 있습니다. 크세논 화합물, 특히 산소-Xenon 화합물은 독성이 있고 폭발성 일 수 있습니다.
크세논의 공급원
크세논은 지구 대기에서 드문 가스로, 1,150 만 (백만 분당 0.087 부) 당 약 1 부로 존재합니다. 드물지만 요소의 가장 좋은 공급원은 액체 공기에서 추출하는 것입니다. 크세논은 또한 마티안 대기에서 거의 같은 농도에서 발생합니다. 요소는 태양, 운석 및 목성에서 발견되었습니다. 오랫동안 과학자들은 대기가 지구상에서 유일한 크세논의 공급원이라고 생각했지만 공기의 농도는 지구에 예상되는 양과 일치하지 않았습니다. 연구원들은 가스가 일부 미네랄 스프링에 의해 방출된다는 것을 발견 했으므로 Xenon도 지구 내에 존재합니다. 지구의 핵심에서 소위 "누락 된 크세논"이 발견 될 수 있으며 철과 니켈에 결합 될 수 있습니다.
Xenon 사용
Xenon은 사진 플래시, 자동차 헤드 램프, 스트로브 및 살균 램프를 포함한 가스 방전 램프에 사용됩니다 (스펙트럼에는 강한 자외선 성분이 포함되어 있기 때문에). 스펙트럼은 자연 햇빛과 가깝기 때문에 영화 프로젝트 램프 및 고급 손전등에 사용됩니다. 근적외선 방출로 인해 야간 시력 시스템에 사용됩니다. 크세논과 네온의 혼합물은 플라즈마 디스플레이의 구성 요소입니다.
첫 번째 엑시머 레이저는 크세논 이량 체 (xe 2 를 사용했습니다 ). 크세논은 여러 유형의 레이저에 인기있는 요소입니다.
의학에서 Xenon은 전신 마취, 신경 보호제 및 심장 보호제입니다. 적혈구 생산 및 성능을 높이기 위해 스포츠 도핑에 사용됩니다. 동위 원소 XE-133은 단일 광자 방출 컴퓨터 단층 촬영에 사용되는 반면, XE-129는 자기 공명 영상 (MRI)의 조영제로 사용됩니다. 크세논 클로라이드 엑시머 레이저는 일부 피부과 절차에 사용됩니다.
크세논은 또한 표면 특성화를 돕기 위해 핵 자기 공명 (NMR)에 사용됩니다. 그것은 버블 챔버, 열량 미터 및 이온 추진 추진제로 사용됩니다.
크세논 화합물
고귀한 가스는 비교적 불활성이지만 일부 화합물을 형성합니다. Xenon Hexafluoroplatinate는 지금까지 합성 된 최초의 고귀한 가스 화합물이었다. 염화물, 불소, 산화물, 질산염 및 금속 복합체를 포함한 80 개가 넘는 크세논 화합물이 알려져 있습니다.
물리적 데이터
밀도 (STP에서) : 5.894 g/l
용융점 : 161.40 K (-111.75 ° C, -169.15 ° F)
끓는점 : 165.051 K (-108.099 ° C, -162.578 ° F)
트리플 포인트 : 161.405 K, 81.77 KPA
임계점 : 289.733 K, 5.842 MPa
20ºC의 상태 : 가스
융합의 열 : 2.27 kj/mol
기화의 열 : 12.64 kj/mol
어금니 열 용량 : 21.01 J/(mol · K)
열전도율 : 5.65 × 10 W/(M · K)
결정 구조 : 얼굴 중심 입방 (FCC)
자기 순서 : diamagnetic
원자 데이터
공유 반경 : 140 ± 9 pm
van der waals 반경 : 216 PM
전기 음성 : 폴링 스케일 :2.6
1 이온화 에너지 : 1170.4 kj/mol
2 이온화 에너지 : 046.4 kj/mol
3 이온화 에너지 : 3099.4 kj/mol
일반적인 산화 상태 : 일반적으로 0이지만 +1, +2, +4, +6, +8
재미있는 크세논 사실
- 크세논은 공기보다 밀도가 높기 때문에 깊은 음성 (헬륨의 반대)을 생성하는 데 사용될 수 있습니다. 그러나 크세논은 마취제이기 때문에이 목적으로 자주 사용되지 않습니다.
- 마찬가지로, Xenon 가스로 풍선을 채우면 바닥에 가라 앉습니다.
- 크세논 가스, 액체 및 고체는 무색이지만 하늘색의 요소의 금속 고체 상태가 있습니다.
- 핵 핵분열 (후쿠시마 반응기와 같은)은 방사성 동위 원소 요오드 -135를 생성 할 수 있습니다. 요오드 -135는 방사성 동위 원소 Xenon-135를 생성하기 위해 베타 붕괴를 겪습니다.
참조
- Bartlett, Neil (2003). "고귀한 가스." 화학 및 공학 뉴스 . 미국 화학 학회. 81 (36) :32–34. doi :10.1021/cen-v081n036.p032
- Brock, David S.; Schrobilgen (2011). “크세논의 누락 된 산화물의 합성, xeo 2 지구의 빠진 크세논에 미치는 영향.” j. 오전. 화학 Soc. 2011, 133, 16, 6265–6269. doi :10.1021/ja110618g
- Greenwood, Norman N.; Earnshaw, Alan (1997). 요소의 화학 (제 2 판). Butterworth-Heinemann. ISBN 0-08-037941-9.
- Meija, J.; et al. (2016). "2013 년 요소의 원자량 (IUPAC 기술 보고서). 순수하고 응용 화학 . 88 (3) :265–91. doi :10.1515/Pac-2015-0305