핵심 개념
이 기사에서는 산을 구성하는 것의 기본 정의와 산성 명명 규칙 를 배웁니다. . 또한 물에 얼마나 강하고 약산이 분리되는지에 대해 배울 것입니다.
다른 기사에서 다루는 주제
- KSP - 용해도 제품 상수
- 단일 프로토, 트리 프로토 성 및 다발성 산
- 용해도 가란 무엇입니까?
- 용해도 규칙 및 차트
- 평형 상수는 무엇입니까?
산 란?
산은 Brønsted -lowry 산으로 알려진 양성자를 기증 할 수있는 분자 또는 이온입니다. 산은 또한 루이스 산으로 알려진 전자 쌍과 공유 결합을 형성하는 분자로 정의 될 수있다. 산은 항상 이온이나 분자가 될 것입니다. 산은 어떻게 분자입니까? 글쎄, 모든 산은 비금속으로 구성되며 분자는 공유 결합의 또 다른 이름 일뿐입니다. 수소 이온 (수소는 하나의 양성자 만 포함하기 때문에 양성자라고도 함)은 산의 핵심 요소입니다. 산을 식별하는 또 다른 좋은 방법은 화학 방정식에서 (aq) 기호를 찾는 것입니다. 이것은 용액이 수성임을 나타냅니다. 즉, 물에 용해 될 것입니다. 수성이 될 종 중 하나가 H라면, 그것은 산을 나타내는 것입니다.
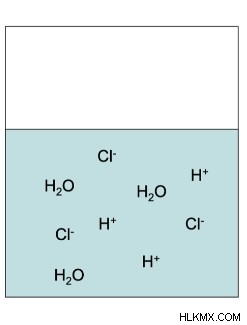
우리 대부분은 이전에 산에 대해 들어 보았지만 산을 강하거나 약한 것으로 분류하는 것은 무엇입니까? 수소 원자가 완전히 분리되거나 부분적으로 분리되는지 여부는 산이 강한 지 약한지 여부를 결정합니다. 이것은 산이 물의 비이커에 배치 될 때 강산이 용액의 원래 분자로부터 100% 분리 된 것으로 밝혀진다는 것을 의미한다. 황산, 질산, 염산, 히드로브로 산, 하이드로 요산 및 과염산의 6 가지 강산 만 있습니다.
HCl (염산)과 HF (Hydrofluoric Acid)를 예로 사용합시다.
염산의 화학적 공식 :HCl (aq) → h (aq) + cl (aq)
히드로 플루오르 산에 대한 화학적 공식 :HF (aq) h (aq) + f (aq)
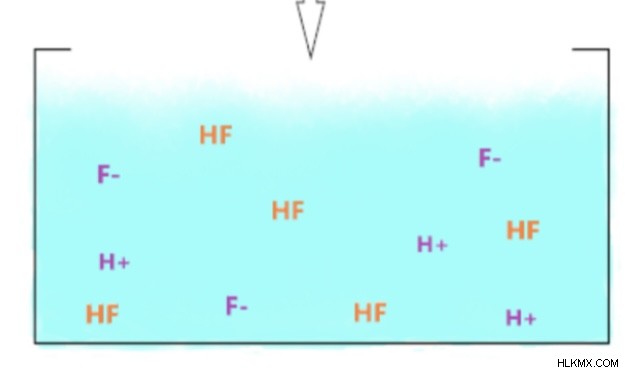
화학 방정식에 기초하여 HCl은 강산이기 때문에 완전히 분리됩니다. 그러나, HF는 불소 및 수소 이온뿐만 아니라 용액에 온전한 HF가 있기 때문에 그 방정식에 평형 화살표를 갖는다. HF는 물 분자에 부착되어 해당 용액을 기본으로 만들 것입니다.
산의 이름을 지정하는 방법
산소를 산소로 명명
예제 1 번 질산-
- 먼저 - 다 원자 음이온을 식별하십시오 H NO 3 → no 3 이것이 질산염이라는 것을 깨달으십시오.
- 둘째 - 다 원자 이온의 이름을 쓰십시오 no
3 =질산염 - 세 번째 -접미사를 -IC 질산으로 변경합니다 → nitric
- 네 번째 - (질산) 이름에 산을 추가하십시오
예 2 황산산-
- 먼저 - 다 원자 음이온을 식별하십시오 H so 3 → so 3 이것이 설파이트라는 것을 깨달으십시오.
- 둘째 - 다 원자 이온의 이름을 쓰십시오 so 3 =설파이트
- 세 번째 -접미사를 -ous 설파이트 으로 변경하십시오 → 황색
- 네 번째 - (황산)이라는 이름에 산성을 추가하십시오
(포스페이트의 철자는 또한 Phosph 또는 로 변합니다 IC 산이 더 잘 들리는 산)
산소를 함유하는 산이 그 폴리아 원자가 음이온을 갖기 때문에 일반적인 다 원자 이온 목록을 암기하는 것이 좋습니다.
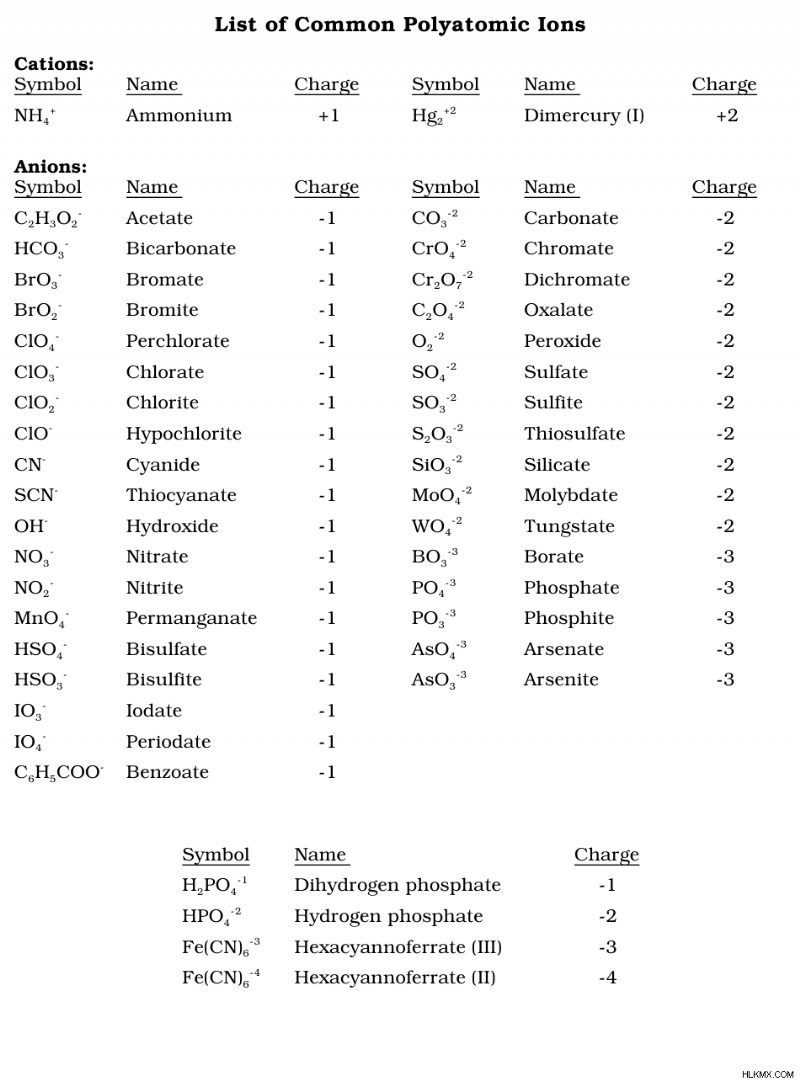
산소가있는 산에 대한 산 명명 규칙을 요약하기 위해 -생성으로 끝나는 다 원자 음이온은 -IC 산이된다. -라이트로 끝나는 다 원자 음이온은 -우산이된다
산소가있는 산에 대한 화학 공식 작성
예제 1 번 클로르 산-
- 먼저 - 수소 양이온의 상징 작성 - h =수소 이온
- 둘째 -접미사 -IC를 접미사 -ate chlor ic 로 대체하여 산의 이름으로 다 원소 음이온을 식별합니다. 산 → 염소산염
- 세 번째 - 다 원자 음이온 클로 레이트의 화학적 공식을 작성하십시오 =Clo
3 - 네 번째 - 수소 양이온의 화학 공식을 결합 및 다 원자 음이온 h 및 clo 3 1 :1 비율 1 (+1) + 1 (-1) =0입니다. 이것은 화합물이 중성 HClo
3 임을 의미합니다 - Fifth - 우리는 물질이 수용액이라는 것을 알 수 있도록 첨자 (aq)를 작성하십시오.
산소가없는 산을 명명
예제 1 번 hcl -
- 먼저 - Monatomic Anion HCl → Cl 를 식별하십시오
- 둘째 - Monatomic Anion CL =클로라이드의 이름을 쓰십시오
- 세 번째 -모나토미아 음이온의 접미사를 -IC로 교체하십시오. 클로라이드 → 클로르 틱
- 네 번째 - 접두사 hydro 을 추가하십시오 그리고 산 . 따라서, 당신은 염산을 얻습니다
예제 번호 2 h 2 s -
- 먼저 - Monatomic Anion H 2 를 식별하십시오 S → S
- 둘째 - Monatomic Anion S =Sulfide의 이름을 쓰십시오
- 세 번째 -모나토미아 음이온의 접미사를 -IC로 교체하십시오. 황화물 → 황색 (철자가 더 나은 소리를 내기 위해 약간 변경됨).
- 네 번째 - 접두사 hydro 을 추가하십시오 그리고 산 . 따라서, 당신은 hydrosulfuric acid를 얻습니다
(인의 철자는 인산도로도 변한다)
산소가없는 산에 대한 산 명명 규칙을 요약하려면 -산소를 함유하지 않는 산의 화학적 이름은 항상 접두사 -Hydro로 시작하여 접미사 -IC로 끝납니다.







