화학에서, 어금니 전도도는 2 개의 평행 전극 사이에 배치 될 때 1 몰의 용해 된 전해질을 함유하는 용액의 전도도이다.
어금니 전도도는 무엇입니까?
어금니 전도도는 용액에서 전해질의 몰을 분해하여 그려진 모든 이온의 전도체 특성 또는 수행 전력으로 불릴 수 있습니다. 그것은 용액에서 전기를 전도하는데 전해질의 효율을 지정하는데 사용되는 전해질 용액의 특성을 갖는다. 따라서 상수는 아닙니다.
어금니 전도도 공식
아래에 주어진 표현은 수학적으로 어금니 전도도 공식을 나타냅니다.
λm =k / c
따라서, 여기서 k =특정 전도도;
c =리터당 두더지의 농도
광범위하게, 전해 용액의 몰 전도도는 단위 면적 단면의 2 개의 전극 사이에 위치되는 전해질의 단위 몰을 포함하는 용액의 부피의 전도도 또는 1 센티미터 간격으로 배치된다.
따라서 어금니 전도도의 단위는 s⋅m2⋅mol-1입니다.
농도에 따른 어금니 전도도의 변화
농도 또는 희석이 감소함에 따라 어금니 전도도의 약하고 강한 전해질이 증가합니다. 이전에 배운 것처럼 어금니 전도도는 하나의 이온에 의해 주어진 전도도입니다. 희석 직후에도 여전히 이온의 정확한 단위 몰을 고려할 것입니다. 그러나, 증가 된 희석은 추가 전해질의 이온으로의 해리에 영향을 미치고 용액 내 활성 이온의 수를 효과적으로 증가시킨다. 따라서 이것은 더 많은 전도도를 부여합니다.
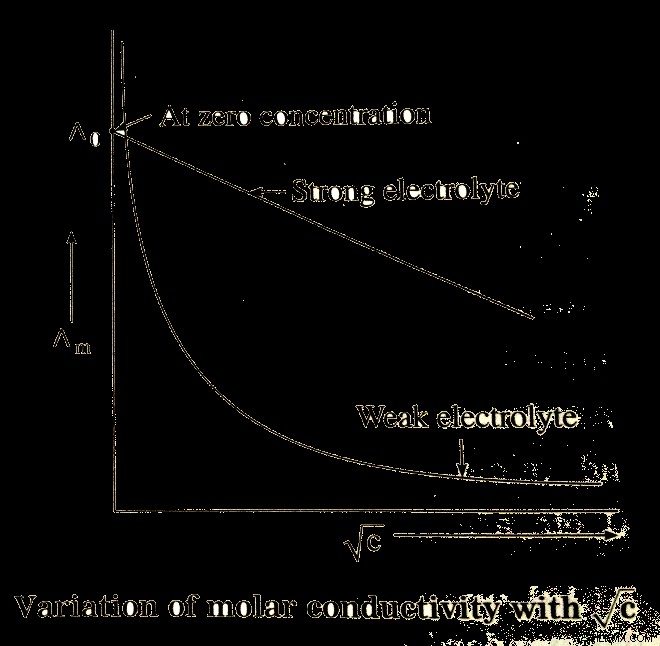
위의 그래프는 강한 전해질의 경우, 어금니 전도도가 희석에 점차 증가하고 있음을 보여줍니다. EOM이 제한되는 어금니 전도도, 즉 제로 농도의 몰 전도도 인 경우, 따라서 강한 전해질의 그래프에 대한 일반 방정식은 Kohlrausch의 법칙을 통해 전달 될 수 있습니다.
λm =eo m - A √ c
여기서
a =플롯의 경사.
주어진 용매에 대해 주어진 온도에서 전해질의 종류에 따라 다릅니다.
약한 전해질은 그럼에도 불구하고 몰 전도도는 낮은 농도로 유지됩니다. 반대로, 이러한 전해질은 해리 정도가 감소하기 때문에 더 높은 농도에서 낮은 몰 전도도를 갖는다.
특정 전도도에서 전해질의 농도가 증가함에 따라 전도도가 증가한다는 것이 인식됩니다. 그것은 용액의 단위 부피에 존재하는 이온의 수에 따라 다릅니다. 희석시, 해리가 증가하여, 전류 운반 이온에 영향을 미쳐 용액을 증가시킨다. 그러나 희석으로 인해 용액의 단위 부피에 존재하는 이온의 수가 감소합니다. 이로 인해 전도도가 감소합니다.
강한 전해질의 경우 농도의 증가는 전도도의 급격한 증가를 자극합니다. 그럼에도 불구하고, 낮은 농도에서 약한 전해질은 특정 전도도의 매우 낮은 값을 유지하고 농도가 증가함에 따라 의도적으로 값이 증가합니다. 이것은 농도로 인한 용액의 활성 이온의 수가 증가함에 따라 발생했습니다.
특정 전도도
특정 전도도는 전기를 전도하는 재료의 능력을 측정하는 것입니다. "K"기호로 표시됩니다. 따라서 정의에 의해 g =r =p.
주어진 전해 용액 샘플이 전류를 전류를 수행 할 수있는 정도를 전류라고 불리는 반면, 주어진 전해 용액 샘플이 전기 전류의 흐름에 저항 할 수있는 정도의 반대를 저항이라고합니다. 따라서 컨덕턴스는 특정 전해 용액의 저항의 역수라고 결론 지을 수 있습니다. Si 단위는 컨덕턴스 (Siemens)입니다.
특정 전도도의 Si 단위는 미터당 Siemens이며 s/m으로 더 잘 나타납니다.
전해 용액의 특정 전도도의 요인에 따라
-
용액에서 전해질의 농도와 특성
-
용액 내 이온 크기
-
용매의 특성과 점도
-
전해 용액의 온도
따라서 다른 전해 용액은 다른 농도를 가지며 다른 수의 이온을 포함합니다. 이 요인으로 인해, 특정 전도도는 상이한 전해 용액의 전도도를 비교하기에 적합한 양이 아니다. 이로 인해 어금니 전도도가 도입됩니다.
전해 전도
전해 용액에 담긴 전극에 전압이 적용되면 전해질 이동의 이온이 전해 용액을 통한 전류가 흐릅니다.
전류 전류를 수행하기위한 전해질의 힘을 전도도 또는 전도도라고합니다. 전해 솔루션은 옴의 법칙을 준수합니다.
그것은 중성 전해질이 물에 용해 될 때 설명하는 Arrhenius 방정식 또는 이론을 기반으로합니다. 전해질 분자는 다르게 하전 된 이온으로 분리됩니다. 양의 이온을 양이온이라고하며 음성이 각각 음이온이라고합니다. 이온은 이미 전해질에 존재하지만 정전기력에 의해 결합되어 중립적이다.
전해 전도도에서의 등가 전도도
우리는 전해 전도가 용액에 1g의 전해질을 용해시킴으로써 생성 된 모든 이온의 전도력으로 불립니다. 그러나 등가 전도도는 2 개의 평행 전극 사이에 배치 할 때 용해 된 물질의 하나의 등가 중량을 함유하는 용액의 부피로 정의됩니다.
결론
따라서, 어금니 전도도는 2 개의 전극이 각각 1cm의 단위 면적 단면의 양전하와 음전하가있는 리터당 몰의 농도로 나뉘어 진 특정 전도도이다.