황산 칼륨은 비료에 광범위한 적용을 갖는 백색 고체입니다. 우리 중 많은 사람들이 비타민, 미네랄 및 단백질을 정제 또는 기타 보충제 형태로 복용하여 필요한 영양을 얻는 데 도움이됩니다. 이 물질은 우리가 자라거나 손상된 조직을 복구하거나 작동하는 데 필요합니다. 그것은 모든 생명체의 사실입니다. 이것은 사람들과 마찬가지로 식물이 비타민을 섭취해야하며 칼륨과 황은 필요한 영양소 중 두 가지라는 것을 의미합니다. 또한 그들은 황산 칼륨, 무기 화학 분자로부터 두 가지를 모두받을 수 있습니다.
.화학 공식 :
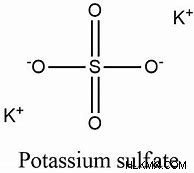
K2SO4는 황산 칼륨의 화학적 공식입니다. 칼륨 (K+) 및 황산염 (SO42-) 이온이 존재합니다. 황산 칼륨의 화학적 공식은 다음과 같습니다.
파생 :
십자형 방법은 황산 칼륨의 화학적 공식을 찾는 데 사용될 수 있습니다. 우리는 다양한 구성 요소의 밸런스를 사용하는 Criss-Cross 접근법을 사용하여 화학 공식을 작성할 수 있습니다. 양수 또는 금속 이온 부호는 왼쪽에 쓰여지고, 부정적인 당사자의 상징은 오른쪽에 기록됩니다. 양의 파트의 원자가 번호는 네거티브 파트의 기호에 첨자로 작성되며, 부정적인 부분의 용도 번호는 양수 부품의 기호의 첨자로 작성됩니다. 첨자는 드문 일입니다. 기소의 증거는 폐기됩니다. 황산 칼륨의 화학식은 이제 황산 칼륨이 칼륨 (K+)과 황산염 (SO42-) 라디칼을 포함하고, 칼륨 이온은 1의 원자가를 가지며, 황산염 라디칼은 2의 원자가를 갖는다. 우리는 황산 칼륨 K2SO4의 화학적 공식을 쓸 수 있습니다.
밸런스를 가로 지르는 것과 같이.
출처 :
화학 물질의 천연 공급원에는 Stassfurt 소금이 풍부한 미네랄이 포함됩니다. Kainite, Schonite, Leonite 및 Polyhalite는 황산 칼륨을 함유하는 미네랄 중 일부입니다. 동등한 미네랄이 물 불용성이면 황산 칼륨을 분리하는 것이 더 쉽습니다. 천연 공급원과는 별도로, 칼륨 칼륨을 화학 반응에서 염화 마그네슘과 함께 염화 마그네슘과 결합하여 만들 수 있습니다.
.준비 :
-
염화 칼륨과 황산 사이의 반응은 황산 칼륨을 거대한 규모로 생성합니다. 초기에, 이황산 칼륨은 중개자로 생산된다.
kcl + h2so4 → hcl + khso4
위의 반응은 발열이며 실온에서 발생합니다. 마지막 단계에서, 바이 설페이트 칼륨은 염화 칼륨과 반응하여 황산 칼륨과 염화 수소를 생성합니다.
KCL + KHSO4 → HCL + K2SO4
위에서 설명한 반응은 흡열입니다.
-
수산화 칼륨은 황산과 반응하여 황산을 형성합니다.
수산화 칼륨과 황산의 상호 작용은 황산 칼륨을 생성합니다.
h2so4 + kcl → k2so4 + h2o
-
칼륨과 황산 반응하여 황산을 형성합니다.
칼륨이 희석 된 황산과 결합되면 황산 칼륨이 형성됩니다.
2K + H2SO4 → K2SO4 + H2
-
황산 칼륨은 황산과 반응하여 황산을 생산합니다.
칼륨 중탄산염이 황산과 결합되면 황산 칼륨이 형성됩니다.
2khco3 + h2so4 → k2so4 + 2h2o + 2co
물리적 특성 :
-
칼륨의 황산염은 하얀 고체입니다. 또한 냄새가 없습니다.
-
그것은 물에 잘 녹아 글리세롤에 약간 가용성입니다.
-
아세톤, 알코올 및 CS2에서 황산 칼륨은 불용성입니다.
-
황산 칼륨은 용융 온도가 1342도이며 화씨 1962 도의 끓는점
-
황산 칼륨 밀도는 2.66 g/cm3입니다.
사용 :
칼륨 황산염에는 광범위한 응용이 있습니다. 그것들은 다음과 같습니다.
-
황산 칼륨의 가장 일반적인 적용은 비료입니다.
-
유리는 황산 칼륨으로 만들어졌으며, 이는 일종의 원유 칼륨 황산염입니다.
-
황산 칼륨은 포병 추진제 전하에서 플래시 억제제로 사용됩니다.
-
황산 칼륨 칼륨이 소다보다 힘들기 때문에 소다 폭파에서 대체 폭발 매체로 사용됩니다.
-
황산 칼륨은 질산 칼륨과 결합 될 때 자주색 불꽃을 만들기 위해 불꽃에 사용됩니다.
-
총구 플래시, 폭발 과압 및 플레어 백은 칼륨 황산염을 사용하여 감소합니다.
-
황산 칼륨은 약에 사용되는 삼투 완하제입니다.
농업 사용 :
칼륨은 효소 활성화, 단백질 합성, 전분 및 설탕 형성, 세포 및 잎의 물 흐름 조절을 포함한 여러 중요한 작업에 필요합니다. 토양의 칼륨 수준은 종종 건강한 식물 성장을 유지하기에 충분하지 않습니다. 식물의 경우 황산 칼륨은 칼륨 영양의 훌륭한 공급원입니다. K2SO4의 K 성분은 다른 인기있는 칼륨 비료의 성분과 동일합니다. 그러나 단백질 합성 및 효소 기능에 필요한 중요한 황 공급원을 제공합니다. 칼륨과 같은 황은 적절한 식물 성장에 불충분 할 수 있습니다. 일부 토양과 작물에서도 추가를 피해야합니다. 그러한 경우, K2SO4는 우수한 칼륨 공급원입니다.
결론 :
칼륨 비료는이 중요한 성분에 부족한 토양에서 자라는 식물의 수율과 품질을 높이는 데 널리 사용됩니다. 칼륨 비료의 대부분은 전 세계의 고대 소금 침전물에서 나옵니다. "칼륨"이라는 문구는 황산 칼륨 (K2SO4, 종종 칼륨 황산염 또는 SOP로 알려진 K2SO4)을 포함한 다양한 칼륨 함유 비료를 나타내는 넓은 용어입니다.