탄수화물은 불안정한 6 전자가 긍정적으로 하전 된 종입니다. 중간체로서의 탄수화물 형성은 반응 과정에서 발생한다. 탄수화물 중간체는 불분자 친 핵성 치환 반응, 단 분자 제거 반응, 알켄의 전자 유전 적 첨가 반응 및 히드로 라이드 이동 또는 알킬 이동을 포함하는 재 배열 반응에서 무한대 짧은 시간 간격에 대해 형성된다. 예를 들어, 바그너 메르 와인 재 배열 등의 탄수화 형성과 같은 일부 중요한 재 배열 반응도 포함됩니다. 알코올 탈수, 수중화 산화 반응, 산화 체중 결정 반응과 같은 반응과 같은 다른 필수 화학 반응은 또한 카보로 형성을 포함합니다.
탄수화물 형성 메커니즘
탄수화물은 두 가지 일반적인 방법 중 하나로 생성됩니다.
-
첫 번째 방법은 이종 분해 결합 절단과 떠나는 그룹을 제거하는 것입니다. 먼저, 탄소 원자와 잎 그룹을 연결하는 결합의 이온화가 발생한다. 그 후, 잎 그룹과 결합 전자는 분자에서 제거됩니다.
-
두 번째 방법은 불포화 결합 (예 :알켄)에 electrophile (h+)을 추가하는 것입니다. 이 전기성의 첨가로 인해 불포화 결합 파괴 및 인접 탄소는 전자 결핍이됩니다. 불포화 본드의 파괴는 탄소를 양전하로 떠납니다.
긍정적으로 하전 된 탄수화물에는 SP2 혼성화가 있습니다. 탄수화물에는 빈 p 궤도가 있으며, 이에 활용되지 않고 양전하로 표현됩니다. 이 표현은 빈 궤도가 전자를 수용 할 수 있음을 나타냅니다.
분자 제거 반응
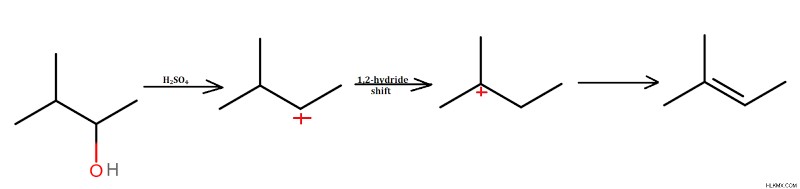
중간체로서 탄수화물이 형성되는 가장 일반적인 반응은 알코올의 탈수입니다. 1 차 탄수화물은 매우 불안정하기 때문에 1 차 알코올은 E2 메커니즘을 통해 제거됩니다. 2 차 및 3 차 알코올은 E1 메커니즘을 따라 알켄을 생성합니다. 황산과 같은 양성자 (H+) 공급원은 알코올을 탈수하는데 사용된다. 탄수화물 형성은 현장에서 떠나는 그룹이 손실 될 때 발생합니다.
알코올의 탈수 :히드 록실 그룹 (OH)은 퇴근 그룹 역할을하여 탄수화물을 형성합니다. 탄수화물은 1,2- 하이드 라이드 이동을 겪고 매우 안정적인 3 차 탄수화물 중간체를 형성한다. 알켄은 마지막 단계에서 형성됩니다.
첨가 반응
탄수화물의 형성과 관련된 알킬 할라이드, 물 또는 할로겐의 첨가와 같은 알켄의 일반적인 첨가 반응이 있습니다.
이 범주에서의 다른 필수 반응은 탄수화 형성을 포함하는 다른 필수 반응은 수중화 산화 및 Oxymercuration demercuration 반응입니다. 탄수화물 형성은 알켄의 불포화 결합의 이종 분해 절단을 통해 발생합니다
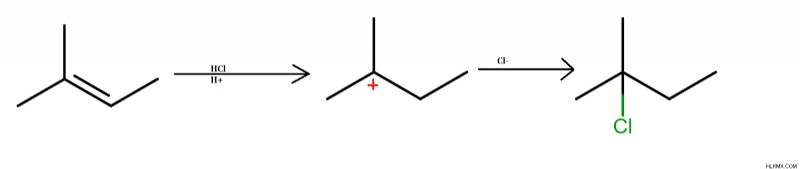
알킬 할라이드의 첨가
할라이드는 염산의 존재하에 불포화 탄소 이중 결합에 삽입됩니다. 탄수화물 중간체의 형성은 반응 과정에서 발생한다. 알킬 할라이드는 반응의 산물로 생성됩니다.
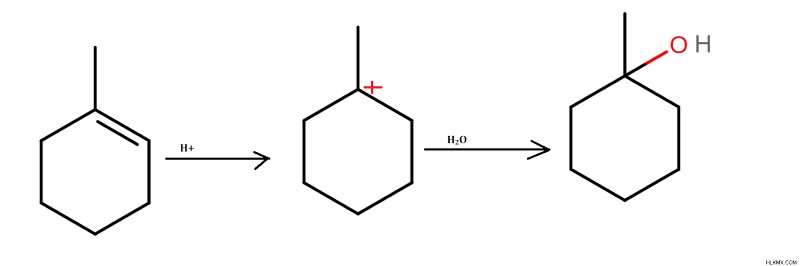
물의 첨가
하이드 록실은 물의 존재하에 불포화 탄소 이중 결합에 삽입됩니다. 탄수화물 중간체의 형성은 반응 과정에서 발생한다. 알코올은 반응의 최종 생성물로 생성됩니다.
할로겐의 첨가
알켄은 브로민과 반응하여 디 브로모 알칸을 제공합니다. 탄수화물 중간체의 형성은 반응 과정에서 발생한다. 이 반응에서 3 원 전이 상태가 형성된다.
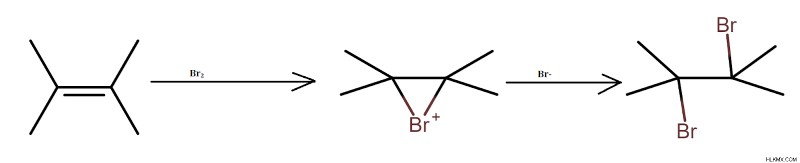
수력 산화
붕소 (bh3)는 수중화에서 알켄의 불포화 결합에 삽입되며, H2O2의 존재 하에서 산화가 발생한다. 수경화 및 산화가 동시에 수행되면, 이러한 반응은 수중 산화 반응으로 알려진다.
OxyMercuration Demercuration
하이드 록실 그룹 (OH)은 Hg (OAC)/H2O 및 NABH4의 존재하에 알켄에 삽입된다. 일반적으로 중간 탄수화물이 더 안정적인 탄수화물을 형성하기 위해 스스로 재 배열 할 수 있기 때문에 두 가지 주요 제품과 작은 제품의 혼합물이 형성됩니다.
비 분자 친 핵성 치환 반응
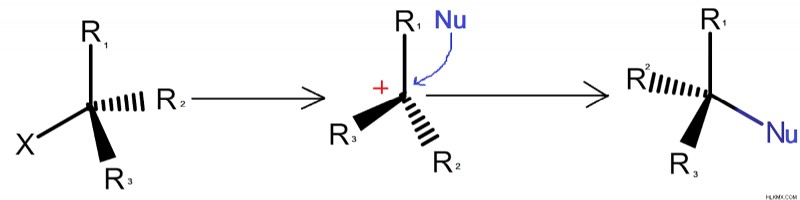
단 분자 친 핵성 치환 반응 또는 SN1 반응은 느립니다. 탄수화물 중간체가 형성되는 단계는 반응의 속도 결정 단계이다. 탄수화물의 형성은 생성물의 역전을 용이하게한다. 카보로 위치 형성은 현장에서 떠나는 그룹이 손실 될 때 발생합니다.
잎 그룹은 주어진 반응에서 탄소에서 분리되어 6 개의 전자 고도로 반응성 탄수화물 중간체를 남겨 둡니다. 탄수화물 중간체의 존재로 인해 반전이 발생하고 들어오는 친핵체가 반대쪽에 부착됩니다.
. 
재 배열
탄소는 매우 불안정하고 반응성입니다. 탄수화물 안정성은 1 차 탄수화물에서 가장 낮습니다. 보조 탄소 및 3 차 탄소가 가장 안정적입니다. 탄수화물이 존재하려면 충분히 안정적이어야합니다. 따라서 안정성을 얻으려면, 탄수화물은 인접한 원자로 재 배열됩니다. 재 배열은 알킬 교대 또는 수 소화물 이동에 의해 일어난다. 탄수화물의 재 배열을 포함하는 일부 명명 된 반응은 피나 콜 반응, 티 페네 데 냐 노프 반응 등입니다. 이러한 반응은 탄수화물 노트의 형성에서 논의되지 않습니다.
결론
탄수화물 형성은 탄수화물 노트의 형성에서 논의 된 두 가지 메커니즘 중 하나에 따라 발생합니다. 탄소는 가장 중요한 중간체 중 하나입니다. 그것은 친 핵성 치환 반응, 제거 반응, 알켄 결합의 첨가 및 재 배열 반응과 같은 일부 주요 반응에서 형성된다. 이러한 반응을 연구하기 전에, 탄수화물의 안정성과 다른 반응에서 형성된 탄수화 유형을 이해해야합니다. Wagner Meerwein 재배치, 피나 콜 반응 및 티 페네 디자 노프 반응은 또한 탄수화 형성과 관련이있다. 이러한 반응을 이해하려면 탄수화물에 대한 철저한 이해가 필요합니다.