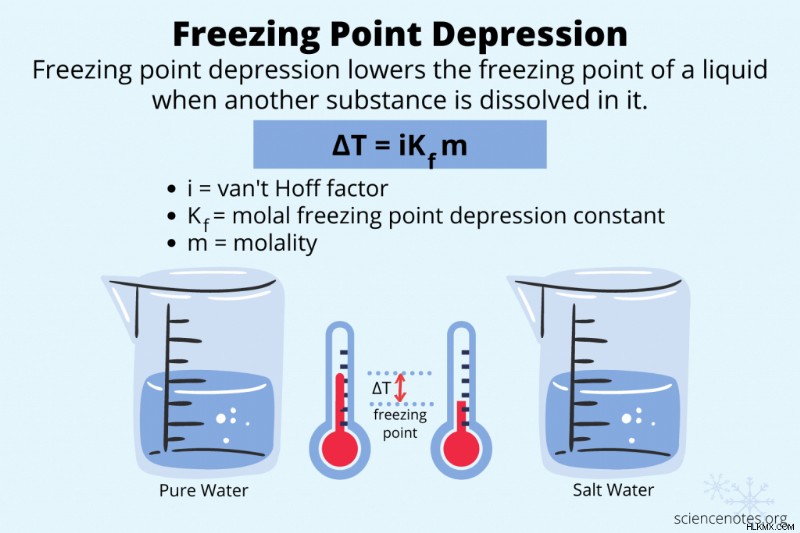
동결 지점 우울증은 다른 물질을 용해시켜 액체의 동결점의 온도를 낮추고 있습니다. 끓는점 높이와 삼투압과 마찬가지로, 그것은 물질의 공동 속성입니다.
. 동결 지점 우울증이 작동하는 방법
이것이 의미하는 바는 동결 지점 우울증의 양이 화학적 동일성이 아닌 액체에 얼마나 많은 입자가 용해되는지에 달려 있다는 것입니다. 따라서, 물에 소금을 용해시키는 동결 지점 우울증은 물에 설탕을 용해시키는 효과보다 큽니다 (C 12 H 22 o 11 ) 각 염 분자는 2 개의 입자 (Na 및 Cl 이온)로 분리되기 때문에 설탕은 용해되지만 해리되지 않습니다. 염화 칼슘 (CACL2)은 물의 3 개의 입자로 분리되어 테이블 소금보다 냉동 지점을 더 잘 압도합니다 (1 개의 Ca 및 2 개의 Cl 이온)
일반적으로 전해질은 비 전해질보다 더 큰 동결 지점 우울증을 유발합니다. 그러나 용매의 용해도도 중요합니다. 따라서 소금 (NaCl)은 불소 마그네슘보다 물에서 더 큰 동결 지점 우울증을 생성합니다 (MGF 2 ). 불소 마그네슘은 3 개의 입자로 분리되고 염분이 3 개의 입자로 분리 되더라도 불소 마그네슘은 물에 불용성이 있습니다.
입자의 수가 차이를 만드는 이유는 이들 입자가 용매 분자 사이를 가져 와서 액체가 얼거나 굳어지게하는 조직과 결합 형성을 방해하기 때문입니다.
동결 지점 우울증 사례
동결 지점 우울증은 일상 생활에서 발생합니다. 다음은 몇 가지 예입니다.
- 해수의 동결 지점은 순수한 물보다 낮습니다. 해수에는 수많은 용해 된 염이 들어 있습니다. 이것의 한 가지 결과는 기온이 0 ° C 미만으로 떨어지면 강과 호수가 겨울에 얼어 붙는다는 것입니다. 바다를 얼리려면 더 차갑게 온도가 필요합니다.
- 얼음 산책에 소금을 넣을 때 얼어 붙은 지점 우울증은 재 조정에서 녹는 얼음이 녹지 않습니다.
- 얼음물에 소금을 첨가하면 냉동실없이 아이스크림을 만들 수있을 정도로 온도가 낮아집니다. 당신이하는 일은 아이스크림 혼합물 봉투를 소금에 절인 얼음 한 그릇에 넣는 것입니다.
- 부동액은 물의 얼어 붙은 지점을 낮추어 겨울에 차량에서 얼어 붙지 않도록합니다.
- 보드카 및 기타 고발성 알코올 음료는 가정 냉동고에서 얼지 않습니다. 알코올은 물의 상당한 동결 지점 우울증을 유발합니다. 그러나 보드카의 동결 지점은 순수한 알코올의 동결 지점보다 높습니다. 따라서 동결 지점 우울증 계산에서 용질 (에탄올)이 아닌 용매 (물)의 동결 지점을 살펴보십시오!
동결 지점 우울증 공식
동결 지점 우울증 공식은 Clausius-Clapeyron 방정식과 Raoult의 법칙을 사용합니다. 희석 된 이상적인 솔루션의 경우, 동결 지점 우울증을위한 공식을 Blagden의 법칙이라고합니다.
Δt f =ik f m
- Δt f 정상 동결 지점과 새로운 동결 지점의 온도 차이
- I는 Van't Hoff 요인입니다. 이것은 용질이 끊어지는 입자의 수
입니다. - KF
- m은 용액의 몰입니다
cryoscopic 상수는 용질이 아닌 용매의 특징입니다. 이 표에는 k f 가 나와 있습니다 일반적인 용매에 대한 값.
| compound | 냉동 지점 (° C) | k f k · kg/mol |
| acetic acid | 16.6 | 3.90 |
| 벤젠 | 5.5 | 5.12 |
| camphor | 179.8 | 39.7 |
| 탄소 이황화 | -112 | 3.8 |
| 탄소 테트라 클로라이드 | -23 | 30 |
| chloroform | -63.5 | 4.68 |
| cyclohexane | 6.4 | 20.2 |
| ethanol | -114.6 | 1.99 |
| Ethyl Ether | -116.2 | 1.79 |
| naphthalene | 80.2 | 6.9 |
| phenol | 41 | 7.27 |
| water | 0 | 1.86 |
동결 지점 우울증을 계산하는 방법 - 예제 문제
동결 지점 우울증 공식은 용질이 용매보다 훨씬 적은 양으로 존재하고 용질이 비 휘발성 일 때 용질이 존재하는 희석 용액에서만 작동합니다.
예제 #1
농도가 0.25m 인 NaCl의 수용액의 동결 지점은 무엇입니까? 물 KF는 1.86 ° C/m입니다.
이 경우, 나는 2가 2입니다. 소금은 물의 2 이온으로 분리되기 때문입니다.
Δt =ik f M =(2) (1.86 ° C/m) (0.25 m) =0.93 ° C.
따라서, 이는 용액의 동결 지점이 수의 정상 동결 지점 (0 ° C)보다 0.93도 낮다는 것을 의미합니다. 새로운 동결 지점은 0 -0.93 =-0.93 ° C입니다.
예제 #2
31.65 그램의 염화나트륨 (NaCl)이 35 ℃에서 220.0ml의 물에 용해 될 때 물의 동결 지점은 무엇입니까? 염화나트륨이 완전히 용해되고 35 ° C에서의 물의 밀도는 0.994 g/ml라고 가정합니다. k f 물의 경우 1.86 ° C · kg/mol.
입니다
먼저, 바닷물의 몰 (m)을 찾으십시오. 몰 리이트는 물 킬로그램 당 NaCl의 두더지 수입니다.
주기율표에서 요소의 원자 질량을 찾으십시오.
원자 질량 NA =22.99
원자 질량 Cl =35.45
NaCl의 두더지 =31.65 g x 1 mol/(22.99 + 35.45)
NaCl의 두더지 =31.65 g x 1 mol/58.44 g
NaCl의 두더지 =0.542 mol
kg 물 =밀도 x 볼륨
kg 물 =0.994 g/ml x 220 ml x 1 kg/1000 g
kg 물 =0.219 kg
m naCl =NaCl/kg 물의 두더지
m naCl =0.542 mol/0.219 kg
m naCl =2.477 mol/kg
다음으로 Van't Hoff 요소를 결정하십시오. 설탕과 같이 분리되지 않는 물질의 경우, 반도가 아닌 인자는 1입니다. 소금은 두 이온으로 분리됩니다 :Na 및 Cl. 그래서 Van't Hoff Factor i 2입니다.
이제 우리는 모든 정보를 가지고 있으며 Δt.
를 계산할 수 있습니다.
Δt =ik f 중
ΔT =2 x 1.86 ° C kg/mol x 2.477 mol/kg
ΔT =9.21 ° C
220.0 ml의 물에 31.65 g의 NaCl을 추가하면 동결 지점을 9.21 ° C로 낮 춥니 다. 물의 정상적인 동결 지점은 0 ° C이므로 새로운 동결 지점은 0 -9.21 또는 -9.21 ° C입니다.
예제 #3
톨루엔 62.2 그램을 녹일 때 동결 지점 우울증은 무엇입니까 (C 7 H 8 ) 481 그램의 나프탈렌에서? 동결 지점 우울증 상수 k f 나프탈렌의 경우 7 ° C · kg/mol.
입니다
먼저 용액의 몰을 계산하십시오. 톨루엔은 이온으로 분리되지 않는 유기 용질이므로 몰 리티는 어금니와 동일합니다.
M =62.2 g/92.1402 g/mol =0.675058 m
톨루엔은 해리되지 않기 때문에 반도가 아닌 요인은 1입니다.
Δt =ik f m =k f M =(7.00 ° C kg mol¯) (0.675058 mol / 0.481 kg) =9.82 ° C
따라서 동결 지점 우울증은 9.82도입니다. 이것은 새로운 동결 지점이 아닌 동결 지점이 낮아지는 양입니다.
참조
- Atkins, Peter (2006). Atkins의 물리 화학 . 옥스포드 대학 출판부. ISBN 0198700725.
- Aylward, Gordon; Findlay, Tristan (2002). SI 화학 데이터 (5th ed.). 스웨덴 :John Wiley &Sons. ISBN 0-470-80044-5.
- ge, Xinlei; Wang, Xidong (2009). "동결 지점 우울증, 끓는점 상승 및 전해질 용액의 기화 엔탈피의 추정". 산업 및 공학 화학 연구 . 48 (10) :5123. doi :10.1021/ie900434h
- Petrucci, Ralph H.; Harwood, William S.; 청어, F. Geoffrey (2002). 일반 화학 (8th ed.). Prentice-Hall. ISBN 0-13-014329-4.