비-비 형성 산화 환원 반응에서 작용하는 세포를 전해 세포라고합니다. 전해 세포는 외부 전압이 적용될 때만 작동합니다. 적용된 외부 전압은 셀에 의해 생성 된 내부 전압, 즉 Ecell보다 커야합니다.
전해 세포는 전기 화학 세포와 반대로 작동합니다. 또한 양극과 음극 인 두 개의 전극으로 구성됩니다. 여기서, 전자의 흐름은 반대 방향, 즉 캐소드에서 양극까지입니다. 전기 세포는 전기 분해에 기초한 작용하는 전해 세포입니다. 전해 세포는 전기 분해를 겪고 물질의 화학적 분해에 사용됩니다.
전기 분해는 용액을 통해 전류를 통과시켜 전해질의 분해입니다. 전기 분해 과정은 전해 세포라고 불리는 장치에 의해 수행됩니다. 시스템에서 작동하는 셀은 화학 시스템을 통해 전류를 통과시켜 건축 할 수 있습니다.
전해 세포의 구성 요소
세 가지 구성 요소로 구성됩니다 :
- 양극 :음의 전극
- 음극 :양의 전극
- 전해질 :염 용액
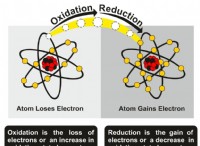
여기서는 전기 화학적 세포의 관습과 반대입니다. 캐소드는 산화를 겪고 양극은 감소합니다. 두 전극 모두 동일한 전해질에 담그다. 외부 전압이 적용되면 전자가 음극에서 양극으로 흐르기 시작합니다. 전해질은 일반적으로 염 용액입니다. 용액으로부터의 양의 이온은 캐소드로 이동하고 음이온은 양극으로 간다.
전기 분해 과정
양이온은 캐소드로 이동하여 전자를 흡수하여 중성 원자가됩니다. 음이온은 양극으로 이동하여 전자를 전달하여 중성 원자를 제공합니다. 화학 반응은 전자를 잃는 음이온과 상응하는 전극에서 전자를 얻는 양이온으로 인해 발생합니다.
예를 들어, HCL의 전기 분해에서 :
로 이온화됩니다.HCL → H + + Cl-
Cl – 이온은 전해 세포에서 양극을 향해 이동하는 반면, H+ 이온은 음극으로 이동합니다. 다음 반응은 전극에서 발생합니다.
음극에서 :H + + E – → H
각 수소 이온은 수소 원자를 생성하기 위해 음극에서 전자를 가져옵니다. 그런 다음 수소 원자는 결합하여 수소 가스 분자, H2를 생성합니다.
양극 :cl- → cl + e-
염화물 이온에 의해 양극에 전자를 잃은 후, 한 쌍의 염소 원자가 결합하여 염소 가스, Cl2.
절차는 HCL이 수소와 염소 가스로 분해됩니다.
전반적인 반응은 다음과 같습니다.
2HCL → H2 + CL2
용융 알칼리 할라이드에서도 전기 분해가 발생할 수 있습니다.
전해질과 갈바니 세포의 차이
| Galvanic Cell | 전해 세포 |
| 화학 에너지를 전기 에너지로 변환합니다. | 전기 에너지를 화학 에너지로 변환합니다. |
| 자발적 | 비 초정간 |
| 소금 다리 또는 다공성 장벽은 다른 용기에 설치 한 두 개의 반 셀을 연결합니다. | 두 전극 모두 동일한 용기에 용융 전해질 용액에 담그는 것입니다. |
| 양극 =음수; 음극 =양성. | 양극 =양성; 음극 =음성, |
| 음극은 산화되고 음극은 감소합니다. | 음극은 산화되고 양극은 감소합니다. |
| 전자는 양극에서 음극으로 이동합니다. | 전자는 음극에서 양극으로 이동합니다. |